INTRODUCTION
패혈증을 진단하기 위해 시행하는 혈액배양의 올바른 과정을 준수하는 것은 매우 중요하다. 하지만 20 mL 이상의 많은 채혈량과 2회 이상 채혈, 무균적 피부소독 등 까다롭고 복잡한 과정은 실제로는 제대로 이루어지기 어렵다. 혈액배양 지표 중 양성률은 높고, 피부 상재균 오염률은 낮은 것이 바람직한데, 이를 위해서는 충분한 양의 채혈과 올바른 피부 소독 및 무균적 채취가 필요하다. 우리나라의 9개 대학병원을 대상으로 조사한 연구에서 호기병 및 혐기병 한 세트 채혈량은 평균 7.7 mL (범위 4.6 – 11.1 mL)에 불과하였다[1]. 649개 의료기관을 대상으로 분석한 미국에서도 마찬가지로 1쌍의 채혈량은 10 mL에 불과하였다[2]. 이는 채혈자가 혈액배양 검사에서 채혈량의 중요성을 잘 모르거나, 혈액배양의 중요성을 간과하기 때문으로 생각되며, 오래 입원한 환자의 경우 혈관 상태가 안 좋아서 충분한 양의 채혈이 어려울 수도 있다.
국내 대학병원을 대상으로 저자 등이 조사한 연구에서 피부상재균 오염률은 2.1% (범위 1.0%-4.1%)이며[1], Clinical Laboratory Standards and Institutes에서는 3% 이하를 권장하고 있다[3]. 피부상재균의 오염은 의료비용의 상승과 입원 기간의 연장, 불필요한 항균제 투여로 이어지기 때문에 이를 줄이기 위해 노력해야 한다[4,5].
저자 등이 이전에 시행한 채혈자에 대한 혈액배양 교육 전후로 비교한 혈액배양 지표 연구에서 채혈량 및 양성률의 향상이 관찰되었다[6]. 이때는 SA, SN (bioMerieux, Durham, NC, USA) 배양병 및 BacT/Alert 3D (bioMerieux) 장비를 사용하였으며, 최근 개발된 FA Plus, FN Plus (bioMerieux) 배양병 및 Virtuo (bioMerieux) 장비를 사용하여 채혈 전담자에 대한 교육효과 연구는 많지 않다. 또한 선행 연구는 3차 의료기관에서 중증도가 높은 환경이었고, 이번 연구는 중증도가 비교적 낮은 2차 의료기관에서 시행하였다. 본 연구에서는 중증도가 낮은 2차 의료기관에서 응급구조사 및 채혈전담 병리사를 대상으로 채혈량 및 피부소독에 대한 교육을 시행하고, 교육 전후의 혈액배양 지표의 변화를 살펴보고자 하였다.
MATERIALS AND METHODS
1. 채혈자 교육 및 채혈
본 연구가 진행된 병원은 경남 창원에 2016년 설립된 2차 의료기관으로서 약 600병상 규모이고 지역응급센터를 두고 있다. 연구가 진행될 당시 성인 중환자실 2개에 약 25병상을 운영하였다. 병원의 업무 흐름상 응급실 및 중환자실은 응급구조사가, 병실은 채혈병리사가 전담하여 혈액배양을 시행하였다. 이들 채혈전담자를 대상으로 이번 연구의 목적 및 방법에 대해서 교육하였고, 그 이후는 비정기적으로 올바른 혈액배양에 대해 지도하였다.
혈액배양에 대한 교육은 연구책임자가 직접 시행하였으며, 발표자료를 사용하여 집체 교육하였고, 내용은 채혈 시기, 채혈 횟수, 채혈량 및 피부소독 방법을 포함하였다. 채혈 시기는 발열 시 시행하는 것을 원칙으로 하지만, 실제로는 이때를 기다렸다 할 수 없으므로 주치의 요청이 있는 경우 시행하는 것으로 하였다. 채혈 횟수는 하루 2회를 기준으로 하고, 기다리지 않고 즉시 2번째 채혈을 하였다. 피부소독은 2% 클로르헥시딘 알코올 솜을 사용하였으며, 3회 이상 도포하고 소독제가 완전히 증발한 후 채혈하도록 하였다. 채혈량은 20 mL를 권장하였으며, 채혈 후 FA Plus호기병에 10 mL, FN Plus 혐기병에 10 mL를 분주하도록 하였다. 응급실 및 중환자실은 20 mL 주사기로 채혈한 반면, 병실에서는 어댑터를 이용하여 정맥으로부터 직접 혈액배양병에 혈액을 주입하였다.
교육은 2019년 2월말 시행하였고, 연구기간은 2018년 11월부터 2019년 2월까지를 교육 전, 2019년 3월부터 6월까지를 교육 후로 정하였다. 교육 후에도 연구가 종료되기 전까지는 지속적으로 채혈자에 대해 지도와 격려, 당부를 하였다. 교육 1개월 전부터 채혈량을 측정하였고, 교육 후에는 4개월 동안 채혈량을 측정하였다. 먼저 병 무게를 재어 병 속의 혈액 무게를 계산하였으며, 계산된 무게에 혈액의 비중 1.055 g/mL로 나누어 채혈량을 구하였다. 적합한 채혈량은 병 1개당 8-12 mL로 정의하였다.
2. 혈액배양
혈액병이 진단검사의학과에 도착하면 1-2시간 이내에 Virtuo 장비에 투입하였고 5일간 배양하였다. 혈액배양 병의 장비 투입은 검사실 도착 즉시 이루어졌으며, 양성으로 나오면 즉시 그람염색을 시행하여 주치의에게 보고하고, 양성으로 나온 시간은 인터페이스를 통해 전산에 기록되었다. 양성 배양 병에서 1 mL주사기로 검체를 채취하여 혈액한천배지, MacConkey배지, 초콜릿배지에 접종하고 16-18시간 동안 CO2배양기에서 배양하였다. 균주 동정은 VITEK MS (bioMerieux, Marcy l’Etoile, France)로 시행하였으며 항균제 감수성검사는 Vitek-2 (bioMerieux)로 진행하였다. 연구기간 중 임상미생물검사실 검사자로 인한 편차를 최소화하기 위해 본 연구 진행은 알리지 않았다.
3. 혈액배양 지표
교육 전후 4개월 동안 호기병 및 혐기병의 채혈량, 양성률, 피부 상재균 오염률 등 혈액배양 지표를 비교하였다. 양성률은 의뢰된 건수에서 균이 배양된 건수의 비율로 정의하며, 의뢰 건수는 호기병 및 혐기병 1세트를 기준으로 하였고, 배양은 이 중 하나라도 양성이면 배양 양성이라고 판단하였다. 피부 상재균 오염률은 의뢰된 건수에서 피부 상재균이 1세트에서만 자란 경우로 정의하였다. 피부 상재균은 coagulase-negative staphylococci, Bacillus spp., Propionibacterium spp., Corynebacterium spp., Micrococcus spp., Aerococcus spp.로 정의하였으며[3] 따로 의무기록을 조사하지는 않았다. 균 검출시간(time to detection)은 혈액병을 장비에 투입한 후 장비에서 양성으로 나오는데까지 걸리는 시간이다. 균 동정시간(time to identification)은 혈액병을 장비에 투입한 후 균주 동정이 이루어져 주치의에게 보고되는데 까지 걸리는 시간이다.
4. 통계 분석 및 연구
교육 전후 각각 4개월간 채혈량, 균 검출시간 및 균 동정시간은 Mann-Whitney test로, 비율은 카이제곱으로 검정하였다. 모든 혈액병에 대해서 무게를 측정하지는 못하였고, 특히 교육 전에는 채혈량 측정이 미진하였다. 교육 전 무게를 측정한 혈액병은 1,725개로서, 통계 분석을 하는 데는 문제가 없는 것으로 판단하였다. 교육 후에는 대부분의 혈액병의 무게를 측정하였다. 통계분석 프로그램은 SPSS, version 22 (IBM, Armonk, NY, USA)를 이용하였다. P 값이 0.05 이하인 경우 통계적으로 유의하다고 판단하였다. 본 연구는 창원경상대학교병원 기관생명윤리위원회(IRB)의 심의면제를 거쳐 진행되었다(IRB No. GNUCH 2020-03-016). 후향적 연구이므로 동의서는 받지 않았다.
RESULTS
1. 채혈량
교육 전 4개월간 1,725개의 혈액배양병, 교육 후 4개월간 8,492개의 혈액배양병에 대해서 채혈량을 비교하였다. 혈액병 한 개당 평균 채혈량은 교육 전 5.4 mL (사분범위 4.1-6.5 mL), 교육 후 7.1 mL (사분범위 5.0-10.1 mL)로 31.5% 증가하였다(P < 0.0001) (Table 1). 호기병은 교육 전 5.3 mL (사분범위 4.1-6.4 mL), 교육 후 7.7 mL (사분범위 5.4-10.2 mL)로 45.3% 증가하였다(P < 0.0001). 혐기병은 교육 전 5.5 mL (사분범위 4.1-6.7 mL), 교육 후 6.4 mL (사분범위 4.7-9.9 mL)로 16.4% 증가하였다(P < 0.0001). 채혈량이 8-12 mL인 경우 적합하다고 판단하였는데, 교육 전 9.1%에서 교육 후 37.8%로 약 4배 정도 향상되었다(Fig. 1).
Table 1
Comparison of indicators of blood cultures between pre- and post- educational intervention period
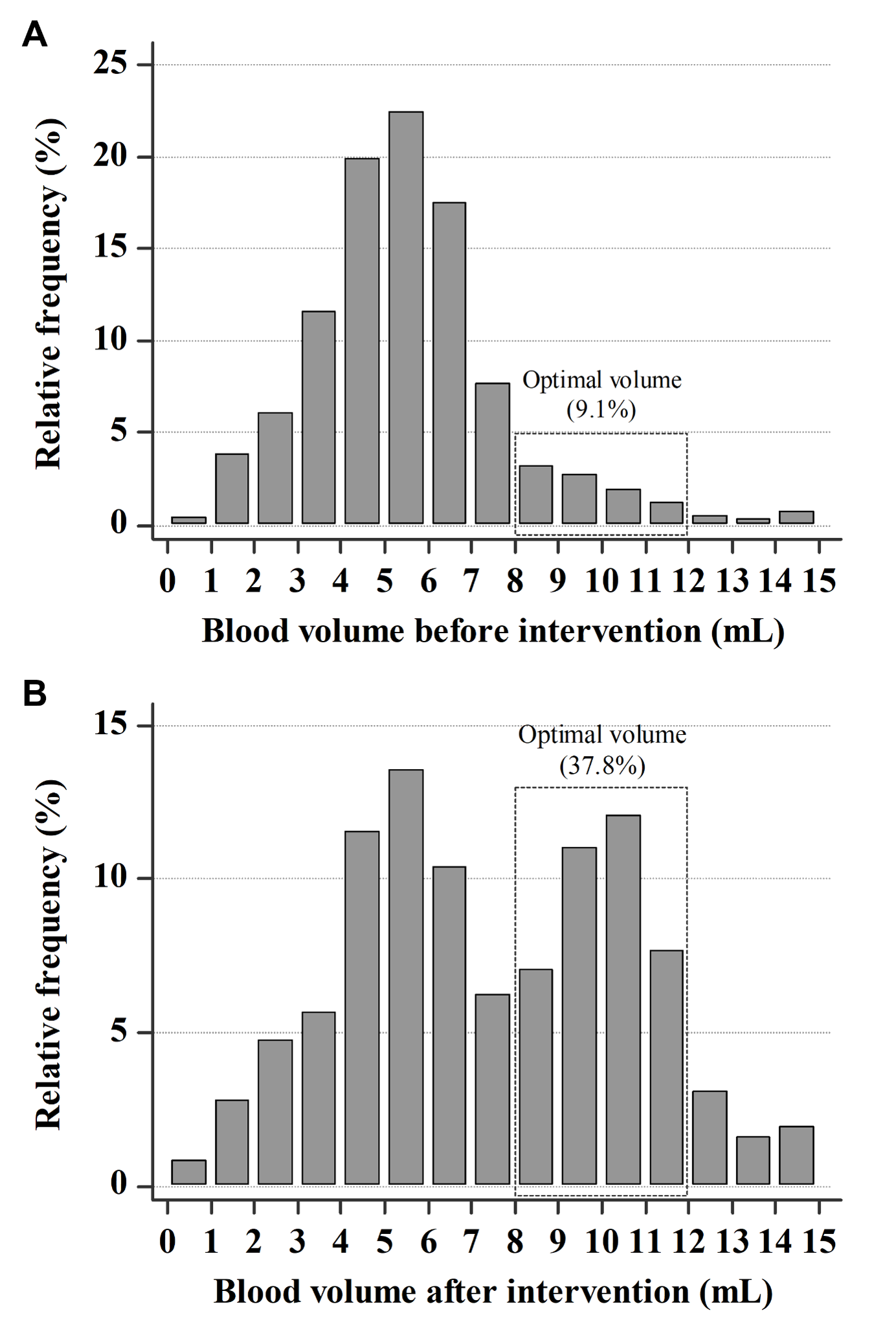
Fig. 1. Distribution of blood volume in blood culture bottles. The optimal volume (8–12 mL) accounted for (A) 9.1% in pre-interventional period and (B) 37.8% in post-interventional period.
2. 혈액배양 지표
혈액배양 지표는 교육 전후 4개월간 혈액배양이 의뢰된 환자를 대상으로 분석하였다. 한 환자 당 2세트의 채혈을 하므로 분석한 혈액배양 세트는 교육 전 4,532세트, 교육 후 4,577세트, 분석한 혈액배양병 수는 교육 전 9,064개, 교육 후 9,154개였다. 혈액배양 양성률은 교육 전 9.6%에서, 교육 후 9.1%로 오히려 약간 감소하여 기대한 양성률 증가는 관찰되지 않았다(P = 0.4237) (Table 1). 피부상재균 오염률은 교육 전 0.5%에서, 교육 후 1.1%로 유의하게 증가하였다(P = 0.0028). 균 검출시간 중앙값은 교육 전 14.7 시간에서, 교육 후 13.2 시간으로 약 1.5시간 감소하였다(P = 0.0420). 균 동정시간 중앙값은 교육 전 81.6 시간에서, 교육 후 72.2 시간으로 약 10시간 감소하였다(P = 0.0183).
3. 채혈자에 따른 혈액배양 지표
응급구조사는 교육 전 5.1 mL (사분범위 4.0-6.0 mL), 교육 후 6.3 mL (사분범위 4.9-9.8 mL)로 23.5% 증가하였다(P < 0.0001) (Table 1). 채혈병리사는 교육 전 6.0 mL (사분범위 4.5-7.7 mL), 교육 후 8.6 mL (사분범위 5.4-10.5 mL)로 43.3% 증가하였다(P < 0.0001). 양성률은 응급구조사 9.2%, 채혈병리사 9.4%로 차이가 없었다(P = 0.7825) (Table 2). 피부 오염률은 응급구조사 0.4%, 채혈병리사 1.4%로 유의한 차이가 있었다(P < 0.0001).
Table 2
Comparison of indicators of blood cultures between emergency medical technicians and laboratory technicians
DISCUSSION
혈액배양의 질 지표로 가장 많이 사용되는 것은 양성률과 피부 상재균 오염률이다. 대개 양성률은 6-12%, 오염률은 3% 이내를 목표로 한다[3]. 채혈자 교육과 코칭, 피드백을 통해 혈액병 채혈량을 3.5 mL에서 9 mL로 향상시킨 연구도 있으며[7], 교육 전후로 병당 ≥ 5 mL 비율이 2.93%에서 71.2%로 상승하는 연구도 있었다[8]. 양성률에 가장 큰 영향을 미치는 것은 채혈량이며, 채혈량에 비례하여 양성률은 증가하고[3,6,8-11], 채혈량이 1 mL 증가할 때마다, 양성률은 2-3%씩 증가한다[10,12]. 미국의 다기관 연구에서 채혈량을 모니터하고 그 결과를 피드백한 결과 채혈량이 2.3 mL에서 8.6 mL로 증가하였고, 양성률은 7.39%에서 8.85%로 상승하였다[12]. 하지만 본 연구에서는 채혈량이 5.4 mL에서 7.1 mL로 평균 1.7 mL 증가했음에도, 양성률은 오히려 9.5%에서 9.1%로 약간 감소하였다. 이는 혈액배양 양성률은 반드시 채혈량에 비례하여 올라가지 않는다는 것을 보여주는 것으로서, 기존의 연구와는 달리 중증도가 낮은 2차 병원의 경우 채혈량보다 오히려 중증도가 양성률을 결정하는데 중요한 요소가 된다는 것을 시사한다[13]. Khare 등[12]의 연구에서도 채혈량은 6.3 mL이나 증가했지만, 병원균 분리율은 1.18배만 증가하여 양성률에 미치는 채혈량의 영향이 크지 않다는 것을 알 수 있다. 또한 국내의 다른 연구에서 채혈량이 2.1 mL에서 5.6 mL로 2배 이상 증가하였지만, 양성률은 5.01%에서 5.87%로 소폭 상승한 것을 알 수 있다[11]. 참고로 교육 전 4개월간 퇴원환자 6,569명의 조사망률은 2.3%, 순사망률은 1.8%였으며, 교육 후 4개월간 퇴원환자 6,022명의 조사망률은 2.6%, 순사망률은 2.1%로서 통계적으로 유의한 차이를 보이지 않았다(각각 P = 0.2630, P = 0.2540).
피부 오염균은 입원일수를 길게 하고, 불필요한 항균제를 투여하여 의료비용을 상승시킨다[4,5]. 피부 오염률을 줄이기 위해서는 올바른 피부 소독제의 도포와 마를 때까지 기다리고, 장갑은 채혈 직전에 착용하여 최대한 무균적으로 채취를 해야 한다. 또한 혈액배양 전용 채혈도구세트, 채혈자에 대한 교육 및 오염률에 대한 피드백, 혈액배양 술기의 표준화 혹은 체크리스트 사용, 피부 소독제 변경 등을 통하여 오염률을 낮출 수 있다[4-6,14,15].
일반적으로 채혈량이 늘면 피부 오염률도 증가할 가능성이 있는데, 본 연구에서도 0.5%에서 1.1%로 약 2배 증가하였다. 이는 채혈자의 숙련도, 무균적 채취술에 대한 이해, 채혈 시간의 지연으로 인한 오염 가능성 증가 등을 원인으로 꼽을 수 있으며, 본 연구에 참여한 채혈자들은 단기간 계약직으로서 자주 퇴사 및 입사가 이루어진 점도 고려해야 한다. 하지만 채혈량이 늘었음에도 오염률은 비슷하거나 오히려 감소한 경우도 있어서[10-12,15], 향후 채혈량과 오염률에 대한 연관성에 대해서는 추가적인 연구가 더 필요하다.
응급실에서 근무하는 응급구조사와 병실에서 채혈을 담당했던 채혈병리사 두 직군 간에 채혈량에 유의한 차이가 있었는데, 이는 동기부여 및 순응도의 차이도 있지만, 주사기로 채혈하는 것 보다 혈액배양 전용 어댑터를 사용하는 것이 충분한 채혈량을 확보하는데 적합한 것으로 판단한다. 입원한 환자는 혈액배양 전 항균제를 투여받을 기회가 더 많기 때문에 응급실 환자보다 양성률이 낮을 가능성이 있는데[16], 본 연구에서는 두 그룹간에 유의한 차이가 없었다.
우리 병원에서는 채혈전담자가 혈액배양을 담당했는데, 채혈전담자는 인턴 의사가 채혈하는 것보다 혈액배양 지표가 더 양호해진다는 국내 병원 보고가 있다[11]. 즉, 채혈전담팀을 운영하고 나서 채혈량은 2배 이상 상승하였고, 오염률은 절반으로 감소하였다. 저자 등[10]의 이전 연구에서도 인턴 의사의 채혈량은 9.2 mL로서, 채혈병리사의 16.7 mL에 비해 훨씬 못 미쳤다[10]. 이때 양성률은 각각 7.9%와 10.3%를 보였고, 오염률(0.8%)은 동일하였다.
균주 동정에 사용한 matrix assisted laser desorption ionization time-of-flight mass spectrometry (MALDI-TOF MS)는 매우 빠르고 정확하게 균주를 동정할 수 있는 장비이며, 특히 신속한 결과가 필요한 혈액배양의 경우 일반 검체와는 별개의 과정으로 진행하여 빠르게 보고하는 검사실이 많다. 하지만 본 검사실에서는 다른 검체와 구분하지 않고, 일상적으로 오후 1시경 하루 한번만 동정을 했기 때문에 균 검출시간과 균 동정시간에는 약 60시간의 큰 차이가 있다. 이를 감안하여도 균 동정시간은 약 10시간 감소하였다. 이는 채혈량의 증가와 더불어 주말이나 야간, 퇴근 시간에 따른 업무의 단절 등이 영향을 미쳤을 것이라고 판단한다. 본 연구에서는 채혈량의 증가로 양성률 증가는 없었지만, 균 검출시간 및 균 동정시간은 단축시키는 결과를 얻었다. 하지만 채혈량과 균 검출시간 간에 연관성이 없는 경우도 있어서[10], 이에 대한 추가 연구가 필요하다.
본 연구는 몇 가지 제한점이 있다. 첫째, 혈액병 무게 측정에 있어서 교육 전에는 일부만 채혈량이 측정되었다. 워낙 혈액병 측정 수가 많아서 측정하지 않은 병의 채혈량과 큰 차이를 보이지는 않을 것이라고 추정하지만, 이는 연구디자인의 제한점으로 작용한다. 둘째, 신규 채혈자에 대한 교육이 지속적으로 이루어지지 못했다. 1회 집체 교육을 진행한 후, 그 이후에는 채혈량과 피부소독에 대해서 간단하게 구두로 설명하고 교육하였지만, 연구 중간에 채혈자가 바뀌는 일이 가끔 있었다. 셋째, 의무기록 조사가 이루어지지 않아서, 단순히 검사실에서의 양성률만 구하였다. 양성으로 자란 균 중에서 실제로 임상적으로 의의가 있는 세균의 양성률이 더 의미가 있으며, 추후 이에 대한 분석이 필요할 것으로 판단한다. 마지막으로 채혈량 증가에도 불구하고 양성률이 증가하지 않은 이유를 정확히 설명하지 못하였고, 본 연구는 2차 의료기관에서 수행되어 중증도가 낮을 것으로 짐작하였지만, 실제로 환자들의 중증도를 기간에 따라 비교하지는 못하였다. 또한 혈액배양 채혈 전 항균제 투여 여부도 양성률에 영향을 미칠 것으로 판단하지만, 본 연구에서는 이에 대한 조사도 이루어지지 못하였다.
결론적으로 2차 의료기관에서 혈액배양의 채혈량이 증가했음에도 불구하고 양성률 증가는 관찰되지 않아서, 양성률은 채혈량 뿐만 아니라 환자의 중증도에 의해서도 크게 영향을 받는다는 것을 추론할 수 있었다.




