Department of 1Laboratory Medicine, 2Infectious Diseases, 3Infection Control Center, National Health Insurance Service Ilsan Hospital, Goyang, 4Division of Infectious Diseases, Department of Internal Medicine Gil Medical Center, Gachon University College of Medicine, Incheon, Korea
Corresponding to Yoonseon Park, E-mail: yoonseony@gmail.com
Ann Clin Microbiol 2022;25(3):85-95. https://doi.org/10.5145/ACM.2022.25.3.4
Received on 24 August 2022, Revised on 13 September 2022, Accepted on 13 September 2022, Published on 20 September 2022.
Copyright © Korean Society of Clinical Microbiology.
This is an Open Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (https://creativecommons.org/licenses/by-nc/4.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Background: Due to the COVID-19 pandemic, from 2020, many pharmaceutical companies have developed vaccines. To determine the efficacy of AstraZeneca’s and Pfizer’s vaccines, which were the first and second vaccines to be approved in Korea, respectively, we developed a method to measure their antibody-generating efficacies using immunology analyzers and a rapid antibody test available in Korea.
Methods: The antibody-stimulating efficacies of the Pfizer and AstraZeneca vaccines were evaluated using Centaur® XPT SARS-CoV-2 (Siemens Healthineers, Germany), Elecsys® AntiSARS-CoV-2 S (Roche Diagnostics, Germany), and STANDARD F SARS-CoV-2 nAb FIA (SD Biosensor, Korea). Healthcare workers were enrolled in two groups: the Pfizer (121) and AstraZeneca (117) groups. Antibody levels were measured pre-vaccination, three weeks after vaccination, and 16 weeks after vaccination.
Results: The Pfizer group comprised 41 males and 80 females, while the AstraZeneca group comprised 38 males and 79 females. Antibody results were analyzed after excluding four individuals who had recovered from COVID-19. Between weeks 3 and 16, there was no significant difference (P= 0.5, 1.0) between the results of the Roche and Siemens antibody tests in the Pfizer vaccine group. However, the SD biosensor results comparing with the Roche and Siemens antibody tests at three weeks after the initial vaccination showed a significant difference (P < 0.0001). Analysis of the Roche antibody test results before, at three weeks, and at 16 weeks after the administration of the Pfizer and AstraZeneca vaccines revealed a statistically significant difference between before and at three weeks after the first injection (P < 0.0001).
Conclusion: After two doses of the Pfizer and AstraZeneca vaccines, antibody formation was above the 90th percentile of the measurement range in all subjects.
COVID-19, Evaluation, Immunoassay, Vaccines
코로나19 (Coronavirus disease 2019, COVID-19)는 중증급성호흡기증후군 코로나바이러스2에 의해 유발되는 호흡기질환이다[1]. 2020년부터 코로나19의 전세계적인 감염병 유행으로 인해 많은 제약사들이 코로나19 질환을 예방할 수 있는 백신을 개발하였고 현재도 다수의 제약사들이 다양한 코로나바이러스 변이종에 대한 백신을 추가 개발 및 임상시험 중이다[2–4]. 코로나19 감염에 대해 치료제가 매우 제한적인 상황이고 경구용 치료제가 없는 상황이기 때문에 현재 코로나19에 대한 대응은 PCR 검사를 이용한 빠른 코로나19 진단으로 양성 확진자를 격리하여 추가적인 감염 전파를 막고 백신 접종과 사회적 거리두기 유지를 이용한 감염자 수 감소에 집중되어 있다[5,6].
미국 FDA는 2020년 12월 11일, 처음으로 Pfizer-BioNTech사의 코로나19 백신 BNT162b2 (PfizerBioNTech, New York, NY, United States)을 긴급사용승인했고, 그 이후에 12월 18일 Moderna사의 백신, 2021년 2월 27일 Janssen사의 백신을 긴급사용 승인했다[7]. 우리나라는 식품의약품안전처에서 2021년 2월 10일, 국내에서 처음으로 AstraZeneca사의 바이러스벡터 백신 ChAdOx1 (AstraZeneca, Cambridge, United Kingdom)을 사용 허가했고, 3월 5일에 두번째로 Pfizer사의 mRNA 백신을 사용 허가했다[8].
코로나19 감염에 의해 항체가 형성되는 경우와 백신 접종으로 항체가 형성되는 경우가 있다. 백신 개발 후 백신의 효과를 판정하기 위해서 집단 간 감염률의 차이를 계산하기도 하지만 백신 접종 후 생성되는 중화항체를 검사하는 방법을 이용하는 것이 일반적이다[9]. 코로나바이러스 중 S 단백에 대한 항체를 정성적 또는 정량적으로 검사하는 방법이 제시되었고, 보다 신속하고 편리하게 자동화면역검사기기를 이용해서 검사할 수 있는 체외진단의료기기가 국내외에서 개발되었고 현재 식품의약품안전처의 허가를 받아서 검사에 이용할 수 있다[10].
본 연구에서는 코로나19 감염 예방을 위해 접종한 백신의 종류에 따라 형성되는 항체검사 결과를 현재 국내에서 사용 가능한 자동화면역검사기기와 현장에서 이용 가능한 신속항체검사를 이용해 백신 접종 전과 1차 접종 3주 후, 1차 접종 16주 후의 결과를 측정하고 자동화면역검사의 특이 사항들을 제시하고자 한다.
본 연구는 만 19세부터 69세까지 성인을 대상으로 하였다. 2021년 3월부터 2021년 9월까지 화이자 백신을 투여 받은 121명과 아스트라제네카 백신을 투여 받은 117명의 병원 직원들을 대상으로 연구참여동의서를 취득 후 연구를 진행하였다.
화이자 백신은 1차 접종 3주 후 2차 접종을 시행했고, 아스트라제네카 백신은 1차 접종 후 11주 간격으로 2차 접종을 시행했다. 연구참여 대상자를 대상으로 백신 접종 1일 전(Day 0), 1차 접종 3주 후 및 1차 접종 16주 후에 총 3회 전혈 검체를 SST (serum separator tube) 채혈관에 각각 7 mL씩 채혈했다.
채혈한 SST 채혈관은 바로 냉장원심분리기를 이용해 10분간 3,500 g로 원심분리 후 혈청분리관을 이용해 혈청을 별도로 모아서 -70°C 냉동고에 SARS-CoV-2 항체검사 전까지 보관했다. 검사 당일에는 검사 30분전에 냉동고에서 꺼내서 실온에 녹인 후 검사를 시행했다.
식품의약품안전처에서 체외진단 용도로 정식 허가된 제품 세 종류를 사용했다. 모든 제품은 제조회사가 제시한 보관 및 사용 조건을 준수하고 제품 설명서에 따라 검사를 시행했다. Centaur XPT SARS-CoV-2 (Siemens Healthineers, Erlangen, Germany; Centaur COV2T), Elecsys AntiSARSCoV-2 S (Roche Diagnostics, Mannheim, Germany; Elecsys COV2S) 및 STANDARD F SARSCoV-2 nAb FIA (SD Biosensor, Suwon, Korea; SD COV2)를 사용했다.
지멘스사의 Centaur COV2T는 정량검사 제품으로 ADVIA Centaur XPT 자동화면역검사기기(Siemens)를 이용해서 검사할 수 있고 측정범위는 0.6 – 10 index 이고 이 index값은 1 index를 1 U/mL로 변환할 수 있다. 결정치가 1.0 index 미만은 음성(non-reactive), 1.0 index 이상은 양성(reactive)으로 제품 설명서 기준에 따라 판정하였다.
로슈사의 Elecsys COV2S 는 정량검사 제품으로 Roche사의 e602 자동화면역검사기기(Roche)를 이용해서 검사할 수 있고 검사소요 시간은 18분이다. 측정범위는 0.4 – 250 U/mL이고 결정치가 0.8 U/mL 미만은 음성(non-reactive), 0.8 U/mL 이상은 양성(reactive)으로 판정하였다.
에스디 바이오센서사의 SD COV02는 신속항체검사제품으로 개발되었고 100 uL 검체 접종 15분 후에 별도의 판독기기를 이용하여 양성과 음성 결과판독과 함께 PI (positive index)를 확인할 수 있었다. 결정치가 PI 20 미만은 음성(negative), 20 이상은 양성(positive)으로 판정하였다.
통계분석은 MedCalc 20.111 (MedCalc Software Ltd, Ostend, Belgium)을 이용해 분석했다. 연속형 자료는 스튜던트 t 검정을 사용했고 범주형 자료에 대해 카이제곱검정 또는 맥네마검정을 수행했다.
화이자 백신 투여군 121명은 남자 41명과 여자 80명으로 구성되어 있었고, 연령대 분포는 20 – 29세 24명, 30 – 39세 24명, 40 – 49세 47명, 50 – 59세 26명으로 분포되어 있었다. 아스트라제네카 백신 투여군 117명은 남자 38명과 여자 79명으로 구성되어 있었고, 연령대 분포는 20 – 29세 37명, 30 – 39세 27명, 40 – 49세 27명, 50 – 59세 22명, 60 – 69세 4명으로 분포되어 있었다(Table 1).
Table 1. Demographic data of Pfizer and AstraZeneca vaccine groups
| Demographic data | Pfizer BNT162b2 | AstraZeneca ChAdOx1 | |||||
|---|---|---|---|---|---|---|---|
| Sex | Male | Female | Total | Male | Female | Total | |
| 41 (33.9) | 80 (66.1) | 121 (100.0) | 38 (32.5) | 79 (67.5) | 117 (100.0) | ||
| Age (yr) | |||||||
| 20 – 29 | 5 (12.2) | 19 (23.8) | 24 (19.8) | 2 (5.3) | 35 (44.3) | 37 (31.6) | |
| 30 – 39 | 7 (17.1) | 17 (21.3) | 24 (19.8) | 14 (36.8) | 13 (16.5) | 27 (23.1) | |
| 40 – 49 | 15 (36.6) | 32 (40.0) | 47 (38.8) | 13 (34.2) | 14 (17.7) | 27 (23.1) | |
| 50 – 59 | 14 (34.1) | 12 (15.0) | 26 (21.5) | 8 (21.1) | 14 (17.7) | 22 (18.8) | |
| 60 – 69 | – | – | – | 1 (2.6) | 3 (3.8) | 4 (3.4) | |
| COVID-19 past infection | |||||||
| Yes | 1 (2.4) | 2 (2.5) | 3 (2.5) | – | 1 (1.3) | 1 (0.9) | |
| No | 40 (97.6) | 78 (97.5) | 118 (97.5) | 38 (100.0) | 78 (98.7) | 116 (99.1) | |
Values are presented as n (%). Abbreviation: COVID-19, Coronavirus disease 2019.
화이자 백신을 투여 받은 121명 중 3명이 양성결과를 보였다. 이 3명은 모두 코로나19 기확진자로 확인되었고 모두 완치된 상태였다. 로슈, 지멘스 및 에스디 바이오센서 항체검사 모두에서 양성으로 판정되었고 그 중 두 명은 로슈 항체검사에서 250 U/mL 이상으로 높은 항체가를 나타냈다. 그 외 과거 감염력이 없었던 118명은 로슈와 지멘스 두 자동화면역검사에서는 모두 음성 결과를 나타냈지만, 에스디 바이오센서 신속항체검사에서는 남자와 여자 각각 한 명에서 양성 결과를 보였다. 두 명의 PI 값은 22.5와 23.6으로 결정치인 20 근처였다.
아스트라제네카 백신을 투여 받은 117명 중 1명이 양성결과를 보였다. 이 참여자는 코로나19 기확진자로 확인되었고 완치된 상태였다. 로슈, 지멘스 및 에스디 바이오센서 항체검사 모두에서 양성으로 판정되었고 로슈 항체검사에서 65.7 U/mL로 판정기준치에 비해 높은 항체가를 나타냈다. 그 외 과거 감염력이 없었던 116명은 로슈와 지멘스 두 자동화면역검사와 에스디 바이오센서 신속항체검사에서 모두 음성 결과를 보였다.
화이자 백신을 투여 받은 감염력이 없는 118명을 대상으로 로슈, 지멘스 및 에스디 바이오센서 항체검사를 시행했다. 로슈 항체검사에서는 118명 모두가 양성으로 판정되었고, 지멘스 총항체검사에서는 116명이 양성, 2명이 음성으로 판정되었다. 에스디 바이오센서 신속항체검사에서는 81명이 양성, 37명이 음성으로 판정되었다.
로슈 항체검사에서 100 U/mL 이상으로 높은 항체가를 나타낸 사람은 44명으로 37.3%였고 지멘스 총항체검사에서 index 값이 5 이상인 사람은 74명으로 62.4%였다(Table 2). 지멘스 총항체검사에서 음성 결과를 보인 2명은 로슈 항체검사에서도 각각 2.48 U/mL 과 8.66 U/mL로 상대적으로 낮은 항체결과를 보였다. 로슈 항체결과를 기준으로 판단하면 지멘스 총항체검사의 민감도는 98.3%였다. 에스디 바이오센서 신속항체검사는 로슈 항체검사에서 양성으로 판정된 군에서 항체검사 양성률이 68.6%로 상대적으로 낮은 일치율을 보였다.
아스트라제네카 백신을 투여 받은 감염력이 없는 116명을 대상으로 로슈, 지멘스 및 에스디 바이오센서 항체검사를 시행했다. 로슈 항체검사에서는 111명이 양성, 5명이 음성으로 판정되었고, 지멘스 총항체검사에서는 92명이 양성, 24명이 음성으로 판정되었다. 에스디 바이오센서 신속항체검사에서는 45명이 양성, 71명이 음성으로 판정되었다.
로슈 항체검사에서 100 U/mL 이상으로 높은 항체가를 나타낸 사람은 12명으로 10.3%였고 지멘스 총항체검사에서 index 값이 5 이상인 사람은 34명으로 29.3%였다(Table 3). 지멘스 총항체검사에서 음성 결과를 보인 24명 중 로슈 항체검사에서도 음성 결과를 보인 사람은 5명이었고, 그 외 19명 모두 19.99 U/mL 이하의 상대적으로 낮은 항체결과를 보였다. 로슈 항체결과를 기준으로 판단하면 지멘스 총항체검사의 민감도는 82.9%였다. 에스디 바이오센서 신속항체검사는 로슈 항체검사에서 양성으로 판정된 군에서 항체검사 양성률이 39.6%로 상대적으로 낮은 일치율을 보였다. 로슈 항체검사 결과 측정치 상한을 넘어가는 경우 255 U/mL으로 산정해서 항체의 형성 정도를 정량으로 비교했다.
2차 백신 접종 후 추적 검사를 시행하지 못한 1명을 제외하고 화이자 백신을 2회 투여 받은 감염력이 없는 117명을 대상으로 1차 접종 후 16주에 로슈, 지멘스 및 에스디 바이오센서 항체검사를 시행했다. 로슈와 지멘스 총항체검사에서는 117명 모두가 양성으로 판정되었고, 에스디 바이오센서 신속항체검사에서는 115명이 양성, 2명이 음성으로 판정되었다.
로슈 항체검사에서 100 U/mL 이상으로 높은 항체가를 나타낸 사람은 116명으로 99.1%였고 지멘스 총항체검사에서 index 값이 5 이상인 사람은 117명으로 100%였다(Table 2). 에스디 바이오센서 신속항체검사에서 음성인 2명의 대상자는 로슈 항체검사에서는 49.16 U/mL 과 250 U/mL 이상, 지멘스 총항체검사에서 index 값 6.27과 10 이상의 상대적으로 높은 항체가를 나타냈다.
2차 백신 접종 후 추적 검사를 시행하지 못한 52명을 제외하고 아스트라제네카 백신을 2회 투여 받은 감염력이 없는 64명을 대상으로 1차 접종 후 16주에 로슈 및 지멘스 항체검사를 시행했다. 로슈와 지멘스 총항체검사에서는 64명 모두가 양성으로 판정되었다(Table 3).
화이자 백신 투여 군에서 로슈와 지멘스 총항체검사 결과를 양성과 음성으로 비교할 때 3주와 16주 모두 통계적으로 차이가 없었다(P = 0.5, 1.0). 하지만 에스디 바이오센서의 결과는 로슈와 지멘스 두 결과와 1차 접종 후 3주 결과에서 모두 통계적인 차이를 나타냈고(P < 0.0001), 16주 결과는 통계적인 차이가 없었다.
화이자 백신 투여 군과 아스트라제네카 백신 투여 군에서 로슈 항체검사 결과를 백신 투여 전, 투여 3주 후 및 16주 후를 비교했을 때 화이자 군의 3주 후 항체검사 수치는 중앙값 57.1, 제1사분위수 27.7, 제3사분위수 150.8이었고, 아스트라제네카 군의 3주 후 항체검사 수치는 중앙값 14.0, 제1사분위수 6.9, 제3사분위수 45.8이었다. 두 군의 차이는 1차 접종 3주 후에 측정한 결과가 통계적인 차이(P < 0.0001)를 나타내고, 16주 후에는 양성 결과와 항체검사 수치의 차이가 없었다(P = 0.2047) (Fig. 1). 화이자 백신 접종 3주 후 로슈 항체검사 결과와 지멘스 항체검사 결과의 회귀분석 결과는 다음과 같이 로슈 항체결과(Y) = -32.9948 + 18.9242 x 지멘스 항체결과(X), 아스트라제네카 백신 접종 3주 후 로슈 항체결과(Y) = -11.5763 + 12.7533 x 지멘스 항체결과(X)로 두 결과 모두 통계적인 연관성(P < 0.0001)을 나타냈다.
Table 2. Pfizer BNT162b2 seropositive rate and quantitative level of immunoglobin according to Elecsys COV2S and Centaur COV2T
| Quantitation U/mL | Pfizer BNT162b2 – post 3 weeks | Pfizer BNT162b2 – post 16 weeks | |||||
|---|---|---|---|---|---|---|---|
| Male (n = 40) | Female (n = 78) | Total (n = 118) | Male (n = 40) | Female (n = 77) | Total (n = 117)* | ||
| Elecsys COV2S | |||||||
| 0.8 – 19.99 | 4 (10.0) | 15 (19.2) | 19 (16.1) | – | – | – | |
| 20 – 49.99 | 17 (42.5) | 16 (20.5) | 33 (28.0) | – | 1 (1.3) | 1 (0.9) | |
| 50 – 99.99 | 8 (20.0) | 14 (17.9) | 21 (18.6) | – | – | – | |
| 100 – 174.99 | 4< (10.0) | 18 (23.1) | 22 (18.6) | – | – | – | |
| 175 – 249.99 | 3 (7.5) | 9 (11.5) | 12 (10.2) | 1 (2.5) | 1 (1.3) | 2 (1.7) | |
| above 250 | 4 (10.0) | 6 (7.7) | 10 (8.5) | 39 (97.5) | 75 (97.4) | 114 (97.4) | |
| Centaur COV2T | |||||||
| Negative | 1 (2.5) | 1 (1.3) | 2 (1.7) | – | – | – | |
| 1 – 4.99 | 14 (35.0) | 28 (35.9) | 42 (35.6) | – | – | – | |
| 5 – 10 | 12 (30.0) | 18 (23.1) | 30 (25.4) | – | 1 (1.3) | 1 (0.9) | |
| > 10 | 13 (32.5) | 31 (39.7) | 44 (37.3) | 40 (100.0) | 76 (98.7) | 116 (99.1) | |
Values are presented as n (%). *1 subject was not tested at post 16 weeks. Abbreviation: Centaur COV2T, Centaur XPT SARS-CoV-2; Elecsys COV2S, Elecsys Anti-SARSCoV-2 S
Table 3. AstraZeneca ChAdOx1 seropositive rate and quantitative level of immunoglobin according to Elecsys COV2S and Centaur COV2T
| Quantitation U/mL | AstraZeneca ChAdOx1 – post 3 weeks | AstraZeneca ChAdOx1 – post 16 weeks | |||||
|---|---|---|---|---|---|---|---|
| Male (n = 38) | Female (n = 78) | Total (n = 116) | Male (n = 21) | Female (n = 43) | Total (n = 64)* | ||
| Elecsys COV2S | |||||||
| Negative | 2 (5.3) | 3 (3.8) | 5 (4.3) | – | – | – | |
| 0.8 – 19.99 | 20 (52.6) | 44 (56.4) | 64 (55.2) | – | – | – | |
| 20 – 49.99 | 4 (10.5) | 15 (19.2) | 19 (16.4) | – | – | – | |
| 50 – 99.99 | 8 (21.1) | 8 (10.3) | 16 (13.8) | 1 (4.8) | – | 1 (1.6) | |
| 100 – 174.99 | 2 (5.3) | 5 (6.4) | 7 (6.0) | – | – | – | |
| 175 – 249.99 | 1 (2.6) | 1 (1.3) | 2 (1.7) | 1 (4.8) | 4 (9.3) | 5 (7.8) | |
| above 250 | 1 (2.6) | 2 (2.6) | 3 (2.6) | 19 (90.5) | 39 (90.7) | 58 (90.6) | |
| Centaur COV2T | |||||||
| Negative | 7 (18.4) | 17 (21.8) | 24 (20.7) | – | – | – | |
| 1 – 4.99 | 17 (44.7) | 41 (52.6) | 58 (50.0) | – | – | – | |
| 5 – 10 | 3 (7.9) | 8 (10.3) | 11 (9.5) | 1 (4.8) | – | 1 (1.6) | |
| > 10 | 11 (28.9) | 12 (15.4) | 23 (19.8) | 20 (95.2) | 43 (100.0) | 63 (98.4) | |
Values are presented as n (%). *52 subjects were not tested at post 16 weeks. Abbreviation: Centaur COV2T, Centaur XPT SARS-CoV-2; Elecsys COV2S, Elecsys Anti-SARSCoV-2 S
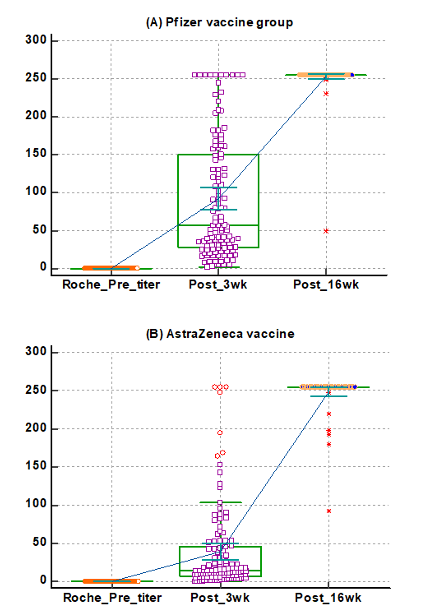
Fig. 1. 3 weeks and 16 weeks post-vaccination antibody titer by vaccine groups, (A) Pfizer vaccine group (B) AstraZeneca vaccine group.
코로나19의 전세계적 감염 확산과 사망자 증가는 수많은 나라의 보건 문제가 되었다. 코로나19에 대한 표준적인 항바이러스제 치료 지침이 없는 상황에서 국가간 감염확산을 막기 위해 입국 전 검사와 격리기간 설정을 보건당국이 결정하고 있고, 우리나라에서도 해외 입국자 대상 realtime PCR 검사를 이용한 감염자 선별을 시행하고 있었고 2022년 오미크론 감염 유행이 줄어들고 나서야 감염자 선별과 격리 관련 지침을 완화했다. 코로나19 치료제 개발 전에는 백신 개발을 위해 전세계의 주요 제약회사들이 기존 아데노바이러스 벡터 방식과 새로운 mRNA 방식의 백신 개발을 신속하게 진행했고[11] 빠르게 사용할 수 있도록 미국 FDA나 국내 식품의약품안전처 등 각 국의 제약관련 규제기관들이 허가 심사를 시행했다.
충분한 백신 생산이 되지 않고 있는 판데믹 초기에 어떤 나라에 우선적으로 공급할 것인가와 국가 내에서 어떤 사람들에게 먼저 공급할 지는 윤리적인 문제도 되지만 또한 제한된 수의 백신을 이용해 투약했을 때 감염자 확산과 위중증 또는 사망자 감소의 효과가 큰 대상을 찾아야하는 의학적 및 사회학적인 근거가 필요할 일이다[12,13]. 일반적으로 호흡기 질환 등 기저질환이 있거나 65세 이상 연령층과 같은 고위험군과 코로나19 진료를 담당하는 의료관련 인력에 대해 우선적인 백신 접종이 한 국가에서 의료역량을 보존하고 사망자를 감소시킬 수 있는 전략으로 판단된다.
연구자들의 병원은 코로나19 거점 전담병원으로 중증, 준중증 및 중등증 환자 대상 입원치료를 하도록 지정되었기 때문에 식품의약품안전처에서 2021년 2월 10일 아스트라제네카 백신 및 3월 5일 화이자 백신 긴급사용승인 이후 백신 접종을 우선적으로 할 수 있도록 지원되었다. 코로나19 확진환자 또는 의심환자를 진료 또는 밀접 접촉할 수 있는 의료진과 병원 내 인력을 대상으로 화이자 백신을 3주 간격으로 2회 접종하였고 환자와의 접촉이 상대적으로 적은 행정직 인력을 대상으로 아스트라제네카 백신을 11주 간격으로 2회 접종하였다. 연구 대상자는 가능한 두 백신 접종자를 비슷한 숫자로 참여 등록 진행하였다. 두 백신 접종군 모두 여성이 두 배 정도를 차지하는 것은 간호사 직종이 가장 많은 부분을 차지하는 의료기관 종사자의 인력구성이 남자보다 여자들이 많은 원인으로 판단된다. 60세 이상 참여자가 4명에 불과한 것은 현재 병원 내 근무자를 대상으로 연구 참여 등록을 진행했기 때문에 70세 이상 고연령층의 참여는 불가능한 한계가 있었다. 1차 및 2차 백신 접종 간격은 제조사 및 국내 질병관리청의 권고사항에 따라 mRNA 백신인 화이자는 3주 간격으로, 바이러스 벡터 백신인 아스트라제네카는 8-12주 간격에 포함되는 11주 간격으로 접종해서 허가기준을 만족했다.
연구대상자 선정 시 제외기준에 코로나19 감염 후 완치자가 없었기 때문에 연구 대상자 중 총 4명이 백신 접종 전 검사에서 항체 양성결과를 보였다. 확진 후 회복된 사람들을 대상으로도 백신 접종은 금기가 아니고 완치 후 6개월 후 백신 접종을 권고하고 있기 때문에 감염 경력으로 인해 이미 항체를 가지고 있는 경우에 백신을 접종하는 경우 항체가의 변화를 볼 수 있는 사례라고 판단된다. 항체가가 검출 범위인 250 U/mL 이상으로 보고되는 로슈 항체검사의 경우, 최대 10배까지 희석 후 검사해서 최대 결과보고치를 2,500 U/mL까지 보고 가능하지만 본 연구에서는 추가적인 희석 후 검사를 시행하지 않아서 정량검사 범위를 충분히 높게 측정하지 못한 점이 한계점이라고 볼 수 있겠다. 전체 연구 대상자 238명 중 4명의 과거 코로나19 감염 후 완치자를 제외한 234명은 모두 감염경력이 없기 때문에 코로나19 항체가 없을 것으로 임상적 판단을 할 수 있다. 로슈와 지멘스 등 자동화면역검사는 신속항체검사보다 일반적으로 특이도가 높고[14,15] 본 연구에서도 100%의 특이도를 나타냈다. 신속항체검사인 에스디 바이오센서는 99.1%의 우수한 특이도를 보였다.
아스트라제네카 백신 접종 3주 후에 측정한 에스디 바이오센서 신속항체검사 양성 45명 중 1명은 로슈 항체검사와 지멘스 항체검사 모두에서 음성으로 판정되어서 위양성의 가능성이 상대적으로 크다고 판단되었다. 하지만 16주 후 항체검사에서는 추적검사가 누락되어서 확고한 판정을 하기에는 어려웠다. 위양성으로 판단할 때 에스디 바이오센서 신속항체검사의 특이도는 97.8%로 추정할 수 있었다.
백신 투여 초기에 해당하는 1차 접종 후 3주 시점에서 항체검사를 했을 때, 자동화면역검사인 로슈와 지멘스 두 검사방법은 모두 초기에 항체 생성을 잘 검출할 수 있었다. 하지만 신속항체검사법은 자동화면역검사법에 비해 상대적으로 낮은 항체역가를 잘 검출하지 못하는 양상을 나타냈다. Dimeglio 등[16]의 연구에 따르면 WHO 국제표준품을 이용한 결합항체가와 보호항체가는 상관관계가 있다고 보고하였다. 16주 시점에는 자동화면역검사법으로 시행했을 때 높은 항체역가를 나타냈기 때문에 실제 항체가 코로나19 감염을 막는데 도움이 되는 중화항체 역가도 비례적으로 높을 것으로 판단된다. 중화항체 검사를 시행하는 표준방법은 중화항체검출검사법(Plaque Reduction Neutralizing Test)이지만 이 방법은 자동화 검사를 적용할 수 없고 시간과 인력이 많이 소요되는 한계점이 있다.
항체역가의 보고 범위가 상대적으로 넓은 로슈 자동화면역검사를 시행했을 때 화이자 백신 접종군에 비해 아스트라제네카 접종군에서 초기인 3주 시점에는 항체역가가 통계적으로 유의하게 낮은 것을 알 수 있었지만, 양성과 음성군으로 나누어 비교할 때는 통계적인 유의성은 없었다. 각각 2회 접종이 완료된 1차 접종 후 16주 시점에는 항체역가 및 양성률 모두 통계적인 차이는 관찰되지 않았다.
결론적으로 국내에서 가장 먼저 도입된 화이자와 아스트라제네카 백신 2회 접종 후 항체 형성은 모든 평가 대상자에게 항체검사제품 검출 가능 범위의 90% 이상 수준으로 잘 형성되는 것을 확인할 수 있었다.
배경: 2020년부터 코로나19의 전세계적인 대유행으로 많은 제약회사에서 코로나19 백신을 개발하였다. 국내에서 초기에 첫 번째와 두 번째로 허가된 아스트라제네카사와 화이자사의 백신 접종 후 효과를 판정하기위해 자동화면역검사기기와 현장에서 이용 가능한 신속항체검사를 이용해 항체형성 효과를 측정할 수 있는 방법을 제시하고자 하였다.
방법: 화이자 백신을 투여 받은 121명과 아스트라제네카 백신을 투여 받은 117명의 의료기관 직원들을 대상으로 지멘스사의 ADVIA Centaur XPT SARS-CoV-2 Total, 로슈사의 Elecsys Anti-SARSCoV-2 S 및 에스디 바이오센서사의 STANDARD F SARS-CoV-2 nAb FIA를 검사했다. 백신 접종 전과 1차 접종 3주 후 및 16주 후의 결과를 측정해서 양성 및 음성 결과와 항체 정량수치를 측정했다.
결과: 화이자 백신 투여군 121명은 남자 41명과 여자 80명, 아스트라제네카 백신 투여군 117명은 남자 38명과 여자 79명으로 구성되어 있었다. 4명의 기확진 완치자를 제외하고 항체 결과와 정량수치를 분석했다. 화이자 백신 투여 군에서 로슈와 지멘스 항체검사 결과를 양성과 음성으로 비교할 때 3주와 16주 측정 시기 모두 통계적으로 차이가 없었다(P = 0.5, 1.0). 하지만 에스디 바이오센서의 결과는 로슈와 지멘스 두 결과와 1차 접종 후 3주 결과에서 모두 통계적인 차이를 나타냈고(P < 0.0001) 16주 결과에서는 통계적인 차이가 없었다. 화이자 백신 투여 군과 아스트라제네카 백신 투여 군에서 로슈 항체검사 결과를 백신 투여 전, 투여 3주 후 및 16주 후를 비교했을 때 두 군의 차이는 1차 접종 3주 후에 측정한 결과가 통계적인 차이(P < 0.0001)를 나타내고 16주 후에는 양성 결과와 항체검사 수치의 차이가 없었다(P = 0.2047).
결론: 화이자와 아스트라제네카 백신 2회 접종 후 항체 형성은 모든 평가 대상자에게 항체검사제품 검출 가능 범위의 90% 이상 수준으로 잘 형성되는 것을 확인할 수 있었다.
This study was approved by the institutional review board of National Health Insurance Service Ilsan Hospital (IRB No. NHIMC 2021-02-015) and obtained informed consent from participants.
COVID-19 항체검사 시약을 Siemens, Roche 및 SD Biosensor로부터 제공받았습니다.
본 연구에 도움을 준 감염관리센터의 양연옥 선생님에게 감사의 말씀을 전합니다.
None.
1. Wang C, Horby PW, Hayden FG, Gao GF. A novel coronavirus outbreak of global health concern. Lancet 2020;395:470-3. 

2. Mahase E. Covid-19: Pfizer and BioNTech submit vaccine for US authorisation. BMJ 2020;371:m4552. 

3. Knoll MD and Wonodi C. Oxford-AstraZeneca COVID-19 vaccine efficacy. Lancet 2021;397:72-4. 

4. He X, He C, Hong W, Zhang K, Wei X. The challenges of COVID-19 Delta variant: prevention and vaccine development. MedComm 2021;2:846-54. 


5. Kang SJ, Kim S, Park KH, Jung SI, Shin MH, Kweon SS, et al. Successful control of COVID-19 outbreak through tracing, testing, and isolation: lessons learned from the outbreak control efforts made in a metropolitan city of South Korea. J Infect Public Health 2021;14:1151-4. 


6. Sung H, Roh KH, Hong KH, Seong MW, Ryoo N, Kim HS, et al. COVID-19 molecular testing in Korea: practical essentials and answers from experts based on experiences of emergency use authorization assays. Ann Lab Med 2020;40:439-47. 


7. FDA. COVID-19 Vaccines. https://www.fda.gov/emergency-preparedness-and-response/ coronavirus-disease-2019-covid-19/covid-19-vaccines [Online] (last visited on 15 September 2022).
8. MFDS. COVID-19 Vaccines. https://www.mfds.go.kr/vaccine_covid19.jsp# [Online] (last visited on 15 September 2022).
9. Zhang Y, Zeng G, Pan H, Li C, Hu Y, Chu K, et al. Safety, tolerability, and immunogenicity of an inactivated SARS-CoV-2 vaccine in healthy adults aged 18-59 years: a randomised, doubleblind, placebo-controlled, phase 1/2 clinical trial. Lancet Infect Dis 2021;21:181-92. 

10. Tang MS, Case JB, Franks CE, Chen RE, Anderson NW, Henderson JP, et al. Association between SARS-CoV-2 neutralizing antibodies and commercial serological assays. Clin Chem 2020;66:1538-47. 


11. Polack FP, Thomas SJ, Kitchin N, Absalon J, Gurtman A, Lockhart S, et al. Safety and efficacy of the BNT162b2 mRNA Covid-19 vaccine. N Engl J Med 2020;383:2603-15. 


12. Emanuel EJ, Persad G, Kern A, Buchanan A, Fabre C, Halliday D, et al. An ethical framework for global vaccine allocation. Science 2020;369:1309-12. 


13. Grauer J, Lowen H, Liebchen B. Strategic spatiotemporal vaccine distribution increases the survival rate in an infectious disease like Covid-19. Sci Rep 2020;10:21594. 


14. Padoan A, Bonfante F, Pagliari M, Bortolami A, Negrini D, Zuin S, et al. Analytical and clinical performances of five immunoassays for the detection of SARS-CoV-2 antibodies in comparison with neutralization activity. EBioMedicine 2020;62:103101. 


15. The National SARS-CoV-2 Serology Assay Evaluation Group. Performance characteristics of f ive immunoassays for SARS-CoV-2: a head-to-head benchmark comparison. Lancet Infect Dis 2020;20:1390-400.
16. Dimeglio C, Herin F, Martin-Blondel G, Miedouge M, Izopet J. Antibody titers and protection against a SARS-CoV-2 infection. J Infect 2022;84:248-88. 


1. Wang C, Horby PW, Hayden FG, Gao GF. A novel coronavirus outbreak of global health concern. Lancet 2020;395:470-3.
2. Mahase E. Covid-19: Pfizer and BioNTech submit vaccine for US authorisation. BMJ 2020;371:m4552.
3. Knoll MD and Wonodi C. Oxford-AstraZeneca COVID-19 vaccine efficacy. Lancet 2021;397:72-4.
4. He X, He C, Hong W, Zhang K, Wei X. The challenges of COVID-19 Delta variant: prevention and vaccine development. MedComm 2021;2:846-54.
5. Kang SJ, Kim S, Park KH, Jung SI, Shin MH, Kweon SS, et al. Successful control of COVID-19 outbreak through tracing, testing, and isolation: lessons learned from the outbreak control efforts made in a metropolitan city of South Korea. J Infect Public Health 2021;14:1151-4.
6. Sung H, Roh KH, Hong KH, Seong MW, Ryoo N, Kim HS, et al. COVID-19 molecular testing in Korea: practical essentials and answers from experts based on experiences of emergency use authorization assays. Ann Lab Med 2020;40:439-47.
7. FDA. COVID-19 Vaccines. https://www.fda.gov/emergency-preparedness-and-response/ coronavirus-disease-2019-covid-19/covid-19-vaccines [Online] (last visited on 15 September 2022).
8. MFDS. COVID-19 Vaccines. https://www.mfds.go.kr/vaccine_covid19.jsp# [Online] (last visited on 15 September 2022).
9. Zhang Y, Zeng G, Pan H, Li C, Hu Y, Chu K, et al. Safety, tolerability, and immunogenicity of an inactivated SARS-CoV-2 vaccine in healthy adults aged 18-59 years: a randomised, doubleblind, placebo-controlled, phase 1/2 clinical trial. Lancet Infect Dis 2021;21:181-92.
10. Tang MS, Case JB, Franks CE, Chen RE, Anderson NW, Henderson JP, et al. Association between SARS-CoV-2 neutralizing antibodies and commercial serological assays. Clin Chem 2020;66:1538-47.
11. Polack FP, Thomas SJ, Kitchin N, Absalon J, Gurtman A, Lockhart S, et al. Safety and efficacy of the BNT162b2 mRNA Covid-19 vaccine. N Engl J Med 2020;383:2603-15.
12. Emanuel EJ, Persad G, Kern A, Buchanan A, Fabre C, Halliday D, et al. An ethical framework for global vaccine allocation. Science 2020;369:1309-12.
13. Grauer J, Lowen H, Liebchen B. Strategic spatiotemporal vaccine distribution increases the survival rate in an infectious disease like Covid-19. Sci Rep 2020;10:21594.
14. Padoan A, Bonfante F, Pagliari M, Bortolami A, Negrini D, Zuin S, et al. Analytical and clinical performances of five immunoassays for the detection of SARS-CoV-2 antibodies in comparison with neutralization activity. EBioMedicine 2020;62:103101.
15. The National SARS-CoV-2 Serology Assay Evaluation Group. Performance characteristics of f ive immunoassays for SARS-CoV-2: a head-to-head benchmark comparison. Lancet Infect Dis 2020;20:1390-400.
16. Dimeglio C, Herin F, Martin-Blondel G, Miedouge M, Izopet J. Antibody titers and protection against a SARS-CoV-2 infection. J Infect 2022;84:248-88.