Sang Shin Pyo1,2*![]() , Dae Wui Yoon1,2*
, Dae Wui Yoon1,2*![]() , Hyunjung Kim3
, Hyunjung Kim3![]() , Hiun Suk Chae4
, Hiun Suk Chae4![]() , Hae Kyung Lee3
, Hae Kyung Lee3![]()
1Department of Biomedical Laboratory Science, 2Sleep Medicine Institute, Jungwon University, Goesangun, Chungbuk, Departments of 3Laboratory Medicine, 4Internal Medicine, Uijeongbu St. Mary’s Hospital, College of Medicine, The Catholic University of Korea, Uijeongbu, Korea
*These authors contributed equally to this work.
Corresponding to Hae Kyung Lee, E-mail: hkl@catholic.ac.kr
Ann Clin Microbiol 2023;26(4):103-115. https://doi.org/10.5145/ACM.2023.26.4.103
Received on 30 August 2023, Revised on 21 September 2023, Accepted on 26 October 2023, Published on 20 December 2023.
Copyright © Korean Society of Clinical Microbiology.
This is an Open Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (https://creativecommons.org/licenses/by-nc/4.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Background: Early prediction of bacteremia is important because sepsis may develop if bacteremia is not treated in time. We aimed to determine whether blood tests are clinically useful in predicting gram-negative versus gram-positive bacteremia.
Methods: We retrospectively analyzed the medical records of 16,569 patients who underwent blood culture testing among those who visited St. Mary’s Hospital of Uijeongbu, Catholic University from January 1, 2018 to December 31, 2018. After excluding 15,580 patients with insufficient data for analysis, the total study population was 989.
Results: In the multivariable logistic regression analysis for gram-negative bacteremia, after adjusting for major variables, procalcitonin (odds ratio [OR] 1.02, P < 0.001), high-sensitivity C-reactive protein (OR 1.03, P = 0.010), and albumin (OR 0.55, P = 0.010) were significant. In the same model, lactic acid (OR 1.08, P = 0.010), blood urea nitrogen (BUN) (OR 1.02, P = 0.010), and albumin (OR 0.50, P = 0.005) were significant for gram-positive bacteremia. We constructed blood indicators by combining blood tests that were significant in multivariable logistic regression analysis. Comparing the area under the curve (AUC) of the receiver operating characteristic curve, the AUC of the procalcitonin/albumin ratio in gramnegative bacteremia was significantly higher than that of procalcitonin (0.846 vs. 0.837, P = 0.005), and the AUC of the BUN/albumin ratio in gram-positive bacteremia was significantly higher than that of BUN (0.709 vs. 0.679, P = 0.007).
Conclusion: The procalcitonin/albumin ratio is expected to be helpful in the early prediction of gram-negative bacteremia, whereas the BUN/albumin ratio in the early prediction of gram-positive bacteremia.
Bacteremia, Sepsis, Albumin, Procalcitonin, Blood urea nitrogen
균혈증(bacteremia)은 혈액 중에 세균이 있는 비정상적인 상태를 말한다[1]. 균혈증으로 인해 환자의 면역 체계가 과도하게 활성화되면 혈관 내피세포의 손상이 발생하고 이로 인해 모세혈관에서 혈액 성분들의 누출이 활성화되어 백혈구 이동 또는 부종이 발생되고 이는 혈류량의 감소를 초래한다[2]. 혈류량의 감소는 환자의 의식 변화, 혈압 저하, 저산소증, 소변량 감소로 이어질 수 있다. 균혈증 환자가 적절한 시기에 치료를 받지 못한 경우 장기에 산소 공급이 제대로 이루어 지지 않아 생명을 위협하는 패혈증(sepsis)으로 발전할 수 있다. 특히 저혈압이 동반되거나 혈중 lactic acid 농도가 2 mmol/L 이상인 경우 패혈증 쇼크(septic shock)로 진행될 수 있다[3]. 균혈증 환자에게 항생제가 적절한 때에 투여되지 못하고 지연되면 패혈증으로 인한 이환율(morbidity rate)과 사망률(mortality rate)이 높아지게 된다[4,5]. 그러므로 이환율과 사망률을 낮추기 위해 균혈증의 조기 예측과 신속한 진단이 무엇보다 중요하다.
균혈증의 진단을 위해 가장 널리 사용되는 검사방법인 혈액 배양 검사(blood culture test)는 최소 1일에서 5일까지 배양 시간이 필요하기 때문에 균혈증의 조기 예측이 어려워 진다. 특히 혈액 배양이 피부 상재균이나 혈관 내 카테터 사용으로 인해 오염되면 균혈증의 신속한 진단이 어려울 수 있다[6]. 혈액 배양 검사의 이러한 단점을 극복하고 신속한 균혈증의 진단을 위해 혈액 배양 검사를 보완할 수 있는 다양한 혈액 내 지표에 관한 연구 결과들이 제시되었다[7–9]. 특히 균혈증에 관련된 혈액 검사로써 procalcitonin, C-reactive protein (CRP), blood urea nitrogen (BUN), albumin의 임상적 유용성에 관한 연구들이 많이 진행되었다. 그 중 procalcitonin은 갑상선 C-세포에서 분비되는 calcitonin의 전구체로 건강한 사람에서 혈액 내 낮은 수치를 유지하지만 균혈증 시에 높은 수치를 나타내는 것으로 알려져 있다[10]. CRP는 염증 상태일 경우 간세포에서 생산이 증가하는 급성기 단백질(acute phase protein)로 비특이적 염증 마커로 잘 알려져 있다. 특히 high sensitivity C-reactive protein (hsCRP) 검사는 미세한 염증 상태를 검출해낼 수 있는 것으로 잘 알려져 있지만 균혈증 예측에 있어 procalcitonin보다 검정력이 낮은 것으로 알려져 있다[11]. 단백질의 이화 과정 동안 요소(urea)는 간에서 생성되는 단백질 대사의 최종 산물이다. 혈청 BUN 검사는 혈액 내 요소질소를 측정하는 검사이며 신장 기능을 간접적으로 평가하기 위한 목적으로 활용되며[12], 균혈증 환자에서 높은 경향을 보이는 것으로 알려져 있다[13]. 간에서 합성되는 albumin은 혈액 내에서 가장 높은 비율을 차지하는 단백질이며 혈관 내 교질 삼투압의 유지, 호르몬, 비타민 약물, 칼슘 이온의 수송 등의 다양한 기능을 갖고 있다. 혈청 albumin 수치가 3.5 g/dL 이하로 떨어지는 저알부민혈증(hypoalbuminemia)은 간경화, 영양실조, 신증후군 등을 포함한 여러 가지 다른 만성 질환과 연관되어 나타날 수 있지만[14,15], 균혈증 환자에서도 albumin 수치가 낮아지는 경향을 보인다[16,17].
위에서 살펴본 바와 같이 균혈증의 조기 예측을 위한 다양한 혈액 지표의 유용성에 관한 연구들이 많이 진행되어 왔지만 대부분의 연구들은 세균의 그람 염색성에 따른 구분을 하지 않고 단순히 균혈증에만 초점을 맞추었다는 제한점이 있다. 그람 염색성에 따른 균혈증의 분류는 추후 환자의 약물치료를 위한 항생제 선택에 있어 매우 중요하다. 본 연구에서는 기존에 보고된 혈액 지표들이 그람 음성 균혈증과 그람 양성 균혈증을 예측하는데 있어 임상적 유용성을 갖는지 알아보고자 했다. 이를 위해 병원 기반 환자 데이터를 기반으로 후향적 연구를 수행하였다.
2018년 1월 1일부터 2018년 12월 31일까지 가톨릭대학교 의정부성모병원에 내원한 환자 중 혈액 배양 검사를 실시한 16,569명을 대상으로 의무기록을 후향적으로 분석하였다. 이 때 선정 기준은 환자 내원 후 최초 진행된 혈액 배양 검사만 연구 데이터로 선정하고 follow-up 데이터는 제외하였다. 또한 처음 진행된 혈액 배양 검사와 동시에 진행된 혈액 검사의 데이터만 추출하여 분석하였다. 이 중 분석에 필요한 데이터가 누락된 15,580명을 제외한 후 남은 989명의 데이터를 최종적으로 분석에 사용하였다(Fig. 1).
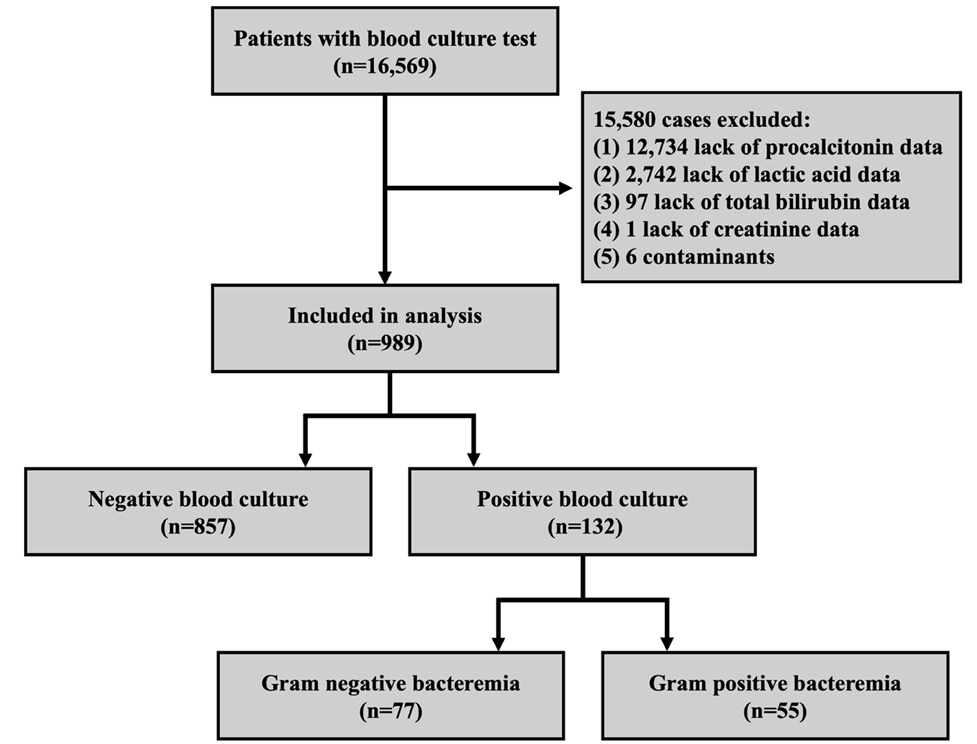
Fig. 1. Flow chart of research samples.
혈액 배양 검사는 BACTEC FX (Becton Dickinson, Sparks, MD, USA)를 이용하여 실시하였다. 전체 혈구 계산(complete blood count)은 XE-2100 (Sysmex, Kobe, Japan)을 사용하였고, 혈액 내 생화학 지표 측정은 Hitachi-7600 (Hitachi, Tokyo, Japan)을 사용하였다.
혈액 검사가 연속형 변수인 경우 샤피로 윌크 정규성 검정(Shapiro-Wilk test)을 실시한 후 모수적 스튜던트 T 검정(Student’s t-test) 또는 비모수적 맨-휘트니 U 검정(Mann-Whitney U test)을 적절히 수행하였다. 혈액 검사가 범주형 변수인 경우 카이제곱 검정(Chi-square test)를 시행하였다. 그람 음성 균혈증 또는 그람 양성 균혈증에 대한 단변수 로지스틱 회귀분석(univariable logistic regression analysis)을 시행하여 통계적으로 유의한 차이가 있는 변수를 확인하였다. 다변수 로지스틱 회귀분석(multivariable logistic regression analysis)에서 모델 1은 연령과 성별만 보정하였고, 모델 2는 모델 1의 보정 변수 외에 white blood cell count, platelet count, creatinine, total bilirubin, glucose를 추가로 보정하여 균혈증에 대한 독립적인 변수가 있는지 확인하였다. 균혈증 예측을 위해 수신기 작동 특성 곡선(receiver operating characteristic curve, ROC curve) 분석을 수행하였다. ROC curve의 곡선하면적(area under the curve, AUC)를 비교하기 위해 Delong 방법을 적용하였다[18]. Cut-off 값은 Youden’s index의 최대값을 기준으로 설정하였다. 통계 분석은 SPSS 24.0 (IBM Corp., Armonk, NY, USA)와 MedCalc 22.002 (MedCalc Software Ltd., Ostend, Belgium)를 이용하였고, 모든 분석은 양측 검정 P < 0.05를 통계적 유의 수준으로 정의하여 분석하였다.
Table 1에 분석에 사용한 989명(남성 574명, 여성 415명)의 기본 특성과 혈액 검사 결과를 나타내었다. 989명 중 혈액 배양 검사를 통해 균혈증으로 진단된 대상은 132명(13.3%)이었다. 균혈증 환자의 평균 연령은 균혈증이 아닌 환자의 평균 연령보다 유의하게 높았다(66.3 ± 18.3 vs. 75.1 ± 11.9, P < 0.001). 균혈증이 아닌 환자보다 균혈증 환자에서 procalcitonin은 유의하게 높았다(6.6 ± 18.1 ng/mL vs. 22.5 ± 32.6 ng/mL, P < 0.001). 또한 BUN도 균혈증이 아닌 환자보다 균혈증 환자에서 유의하게 높았다(31.5 ± 26.7 mg/dL vs. 44.8 ± 29.0 mg/dL, P < 0.001). 반면 albumin 수치는 균혈증이 아닌 환자보다 균혈증 환자에서 유의하게 낮았다(3.6 ± 0.6 g/dL vs. 3.2 ± 0.7 g/dL, P < 0.001). 또한 hsCRP (P < 0.001), lactic acid (P = 0.001), white blood cell count (P = 0.030), creatinine (P = 0.004)은 균혈증 환자에서 유의하게 높았고, platelet count (P = 0.001)는 유의하게 낮았다. 그 밖에 total bilirubin와 glucose는 유의한 차이를 보이지 않았다.
Table 1. Baseline characteristics of study patients
| Characteristic | Total (n = 989) | No bacteremia (n = 857) | Bacteremia (n = 132) | P-value |
|---|---|---|---|---|
| Age (yr) | 067.4 ± 17.8 | 066.3 ± 18.3 | 075.1 ± 11.9 | < 0.001 |
| Sex (male) | 574 (58.0) | 511 (59.6) | 63 (47.7) | 0.010 |
| Procalcitonin (ng/mL) | 008.7 ± 21.3 | 006.6 ± 18.1 | 022.5 ± 32.6 | < 0.001 |
| hsCRP (mg/L) | 009.4 ± 9.4 | 008.9 ± 8.9 | 012.5 ± 11.5 | < 0.001 |
| Lactic acid (mmol/L) | 003.8 ± 3.6 | 003.6 ± 3.4 | 004.9 ± 4.4 | 0.001 |
| BUN (mg/dL) | 033.3 ± 27.3 | 031.5 ± 26.7 | 044.8 ± 29.0 | < 0.001 |
| Albumin (g/dL) | 003.5 ± 0.7 | 003.6 ± 0.6 | 003.2 ± 0.7 | < 0.001 |
| White blood cell count (×103 μL) | 011.7 ± 8.5 | 011.4 ± 8.2 | 013.5 ± 10.0 | 0.030 |
| Platelet count (×103 μL) | 225.5 ± 140.9 | 231.1 ± 141.3 | 189.1 ± 133.1 | 0.001 |
| Creatinine (mg/dL) | 002.2 ± 1.9 | 002.1 ± 1.9 | 002.7 ± 1.9 | 0.004 |
| Total bilirubin (mg/dL) | 001.7 ± 2.4 | 001.7 ± 2.4 | 001.7 ± 2.2 | 0.988 |
| Glucose (mg/dL) | 161.4 ± 116.9 | 160.8 ± 117.1 | 165.7 ± 116.2 | 0.653 |
| Procalcitonin/albumin ratio | 002.7 ± 6.7 | 002.0 ± 5.6 | 007.3 ± 10.6 | < 0.001 |
| hsCRP/albumin ratio | 002.9 ± 3.1 | 002.6 ± 2.8 | 004.2 ± 4.0 | < 0.001 |
| Lactic acid/albumin ratio | 010.2 ± 11.0 | 009.4 ± 9.3 | 015.9 ± 17.7 | < 0.001 |
| BUN/albumin ratio | 009.9 ± 8.7 | 009.2 ± 8.1 | 014.9 ± 10.5 | < 0.001 |
Data are presented as the mean ± standard deviation or n (%). Abbreviations: hsCRP, high sensitivity C-reactive protein; BUN, blood urea nitrogen.
균혈증 환자 132명 중 그람 음성 균혈증은 77건(58.3%), 그람 양성 균혈증은 55건(41.7%) 이었다. Table 2에 그람 음성 균혈증과 그람 양성 균혈증에 대한 procalcitonin, hsCRP, lactic acid, BUN, albumin의 로지스틱 회귀분석 결과를 나타내었다. 그람 음성 균혈증에 대한 단변수 로지스틱 분석에서 procalcitonin (odds ratio [OR] 1.03, P < 0.001), hsCRP (OR 1.05, P < 0.001), lactic acid (OR 1.07, P = 0.020), BUN (OR 1.01, P < 0.001), albumin (OR 0.37, P < 0.001)은 각각 통계적으로 유의하였다. 나이, 성별을 보정한 후 그람 음성 균혈증에 대해 분석한 다변수 로지스틱 회귀분석(모델 1)에서 procalcitonin (OR 1.02, P < 0.001), hsCRP (OR 1.03, P = 0.020), albumin (OR 0.51, P = 0.003)은 유의하였지만 lactic acid, BUN은 유의하지 않았다. 더욱이 모델 1의 보정 변수 외에 white blood cell count, platelet count, creatinine, total bilirubin, glucose를 추가로 보정한 후 그람 음성 균혈증에 대해 분석한 다변수 로지스틱 회귀분석(모델 2)에서 procalcitonin (OR 1.02, P < 0.001), hsCRP (OR 1.03, P = 0.010), albumin (OR 0.55, P = 0.010)는 통계적 유의함을 유지하였다. 모델 2에서 그람 음성 균혈증 환자에 대해 통계적으로 가장 유의한 변수는 procalcitonin (OR 1.02, P < 0.001)이었다.
Table 2. Logistic regression analysis for relation between bacteremia and biochemical variables
| Variable | Gram negative bacteremia (n = 77) | ||||||
|---|---|---|---|---|---|---|---|
| Univariable | Multivariable | ||||||
| OR (95% CI) | P-value | OR (95% CI)* | P-value | OR (95% CI)† | P-value | ||
| Procalcitonin | 1.03 (1.02 – 1.04) | < 0.001 | 1.02 (1.02 – 1.03) | < 0.001 | 1.02 (1.02 – 1.03) | < 0.001 | |
| hsCRP | 1.05 (1.03 – 1.07) | < 0.001 | 1.03 (1.01 – 1.05) | 0.020 | 1.03 (1.01 – 1.06) | 0.010 | |
| Lactic acid | 1.07 (1.01 – 1.13) | 0.020 | 1.04 (0.97 – 1.12) | 0.284 | 1.03 (0.96 – 1.11) | 0.424 | |
| BUN | 1.01 (1.01 – 1.02) | < 0.001 | 1.00 (0.99 – 1.01) | 0.688 | 1.00 (0.99 – 1.01) | 0.893 | |
| Albumin | 0.37 (0.25 – 0.54) | < 0.001 | 0.51 (0.37 – 0.80) | 0.003 | 0.55 (0.35 – 0.87) | 0.010 | |
| Variable | Gram positive bacteremia (n = 55) | ||||||
|---|---|---|---|---|---|---|---|
| Univariable | Multivariable | ||||||
| OR (95% CI) | P-value | OR (95% CI)* | P-value | OR (95% CI)† | P-value | ||
| Procalcitonin | 1.01 (1.00 – 1.02) | 0.144 | 1.00 (0.99 – 1.01) | 0.833 | 1.00 (0.99 – 1.01) | 0.940 | |
| hsCRP | 1.02 (1.00 – 1.04) | 0.287 | 1.00 (0.97 – 1.03) | 0.865 | 0.99 (0.97 – 1.03) | 0.875 | |
| Lactic acid | 1.10 (1.04 – 1.17) | 0.001 | 1.08 (1.02 – 1.15) | 0.011 | 1.08 (1.02 – 1.15) | 0.010 | |
| BUN | 1.02 (1.01 – 1.03) | < 0.001 | 1.02 (1.01 – 1.02) | 0.003 | 1.02 (1.00 – 1.03) | 0.010 | |
| Albumin | 0.41 (0.26 – 0.62) | < 0.001 | 0.49 (0.31 – 0.77) | 0.002 | 0.50 (0.31 – 0.81) | 0.005 | |
*Model 1: adjusted for age, sex; †Model 2: adjusted for age, sex, white blood cell count, platelet count, creatinine, total bilirubin, glucose. Abbreviations: OR, odds ratio; CI, confidence interval; hsCRP, high sensitivity C-reactive protein; BUN, blood urea nitrogen.
그람 양성 균혈증에 대한 단변수 로지스틱 회귀분석에서 lactic acid (OR 1.10, P = 0.001), BUN (OR 1.02, P < 0.001), albumin (OR 0.41, P < 0.001)은 각각 통계적으로 유의하였지만 procalcitonin, hsCRP는 유의하지 않았다. 나이, 성별을 보정한 후 그람 양성 균혈증에 대해 분석한 다변수 로지스틱 회귀분석(모델 1)에서 lactic acid (OR 1.08, P = 0.011), BUN (OR 1.02, P = 0.003), albumin (OR 0.49, P = 0.002)은 유의하였지만 procalcitonin, hsCRP는 유의하지 않았다. 더욱이 모델 1의 보정 변수 외에 white blood cell count, platelet count, creatinine, total bilirubin, glucose를 추가로 보정한 후 그람 양성 균혈증에 대해 분석한 다변수 로지스틱 회귀분석(모델 2)에서 lactic acid (OR 1.08, P = 0.010), BUN (OR 1.02, P = 0.010), albumin (OR 0.50, P = 0.005)는 통계적 유의함을 유지하였다. 모델2에서 그람 양성 균혈증 환자에 대해 통계적으로 가장 유의한 변수는 albumin (OR 0.50, P = 0.005)이였다.
그람 음성 균혈증 환자(OR 0.55, P = 0.010)와 그람 양성 균혈증 환자(OR 0.50, P = 0.005)에서 albumin은 모두 유의하게 나타났다.
그람 세균 특성에 따른 혈액 검사의 진단적 유용성 평가를 위해 ROC curve 분석을 수행하였다(Table 3). 그람 음성 균혈증에서 AUC는 procalcitonin (0.837, 95% CI [confidence interval] 0.81 – 0.86)이 단일 혈액 검사 중에서는 가장 높았고, 그 다음으로 albumin (0.664, 95% CI 0.63 – 0.69)이 높았다. 그람 양성 균혈증에서 AUC는 BUN (0.679, 95% CI 0.65 – 0.71)이 단일 혈액 검사 중에는 가장 높았고, 그 다음으로 lactic acid (0.643, 95% CI 0.61 – 0.67)이 높았다.
Table 3. Area under the receiver operating characteristic (ROC) curve for predicting Gram-negative bacteremia or Gram-positive bacteremia
| Variable | Gram-negative bacteremia (n =77) | ||
|---|---|---|---|
| AUC | 95% CI | P-value* | |
| Procalcitonin | 0.837 | 0.81-0.86 | 0.005 |
| Procalcitonin/albumin ratio | 0.846 | 0.82-0.87 | |
| hsCRP | 0.661 | 0.63-0.69 | < 0.001 |
| hsCRP/albumin ratio | 0.702 | 0.67-0.73 | |
| Lactic acid | 0.610 | 0.58-0.64 | < 0.001 |
| Lactic acid/albumin ratio | 0.636 | 0.61-0.67 | |
| BUN | 0.637 | 0.61-0.67 | < 0.001 |
| BUN/albumin ratio | 0.668 | 0.64-0.70 | |
| Albumin | 0.664 | 0.63-0.69 | – |
| Variable | Gram-positive bacteremia (n = 55) | ||
|---|---|---|---|
| AUC | 95% CI | P-value* | |
| Procalcitonin | 0.607 | 0.57-0.64 | 0.046 |
| Procalcitonin/albumin ratio | 0.616 | 0.58-0.65 | |
| hsCRP | 0.505 | 0.47-0.54 | 0.003 |
| hsCRP/albumin ratio | 0.535 | 0.50-0.57 | |
| Lactic acid | 0.643 | 0.61-0.67 | 0.080 |
| Lactic acid/albumin ratio | 0.659 | 0.63-0.69 | |
| BUN | 0.679 | 0.65-0.71 | 0.007 |
| BUN/albumin ratio | 0.709 | 0.68-0.74 | |
| Albumin | 0.639 | 0.61-0.67 | |
*Comparison of ROC curves was performed using the Delong method. Abbreviations: AUC, area under the curve; CI, confidence interval; hsCRP, high sensitivity C-reactive protein; BUN, blood urea nitrogen.
우리는 균혈증의 예측치를 높이기 위해 다변수 로지스틱 회귀분석에서 유의하게 나타난 혈액 검사들을 조합하여 혈액 지표를 만들었다: 1) procalcitonin/albumin ratio, 2) hsCRP/albumin ratio, 3) lactic acid/albumin ratio, 4) BUN/albumin ratio. 균혈증이 아닌 환자보다 균혈증 환자에서 procalcitonin/ albumin ratio, hsCRP/albumin ratio, lactic acid/albumin ratio, 그리고 BUN/albumin ratio는 유의하게 높았다(P < 0.001) (Table 1).
그람 음성 균혈증에서는 procalcitonin/albumin ratio의 AUC (0.846, P < 0.001)가 가장 높게 나타난 반면(Fig. 2a), 그람 양성 균혈증에서는 BUN/albumin ratio의 AUC (0.709, P < 0.001)가 가장 높게 나타났다(Fig. 2b). 균혈증 예측을 위해 DeLong method를 사용하여 ROC curve의 AUC를 비교하였다. 단일 혈액 검사와 조합하여 만든 혈액 지표 간 AUC를 비교한 결과, 그람 음성 균혈증에서 procalcitonin/albumin ratio의 AUC는 procalcitonin의 AUC보다 유의하게 높았다(0.846 vs. 0.837, P = 0.005) (Table 3). 또한 그람 양성 균혈증에서 BUN/albumin ratio의 AUC는 BUN의 AUC보다 유의하게 높았다(0.709 vs. 0.679, P = 0.007).
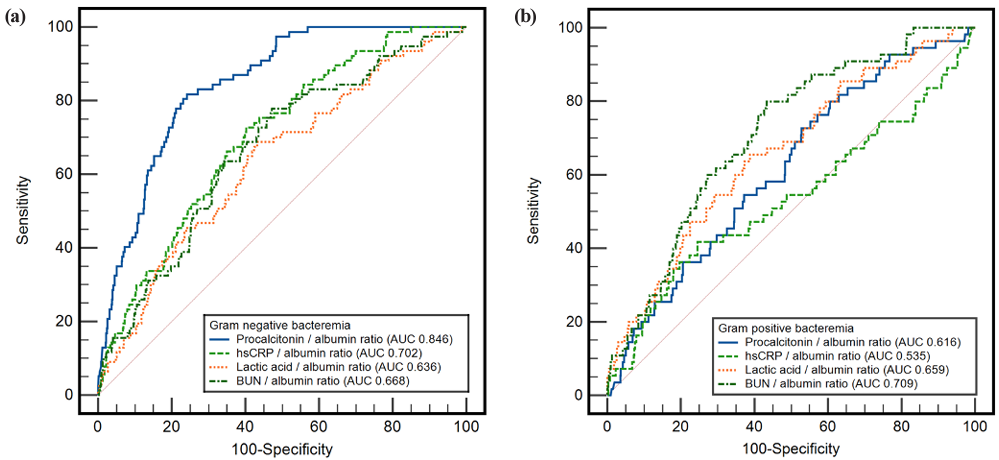
본 연구는 여러 주요 인자들을 보정한 후 다변수 로지스틱 회귀분석에서 그람 음성 균혈증에 대해 procalcitonin, hsCRP, albumin이 통계적으로 유의하게 나타남을 확인하였다. 또한 그람 양성 균혈증에 대해서는 lactic acid, BUN, albumin이 관련이 있음을 확인하였다. 그람 음성 균혈증과 그람 양성 균혈증의 가장 우수한 예측 인자는 각각 procalcitonin과 albumin이었다. 특히 albumin은 그람 음성 균혈증 환자와 그람 양성 균혈증 환자에서 모두 유의한 예측 인자로 확인되었다. AUC 비교를 통해 그람 음성 균혈증에 procalcitonin, hsCRP, albumin과 같은 단일 혈액 검사 보다는 procalcitonin/albumin ratio가 균혈증의 예측에 더 우수하며, 그람 양성 균혈증에는 lactic acid, BUN, albumin와 같은 단일 혈액 검사 보다는 BUN/albumin ratio가 더 높은 예측력을 갖는 것으로 확인되었다.
SENTRY 항균 감시 프로그램에서 1997년과 2016년 사이 45개국의 200개 이상 의료 센터에서 세균성 혈류 감염(bloodstream infection)에 대해 연속적으로 20년 동안 수집하였다[19]. 이 프로그램에서 수집된 세균성 혈류 감염의 가장 흔한 병원균은 황색포도상구균(20.7%), 대장균(20.5%), 폐렴간균(7.7%), 녹농균(5.3%), 장내구균(5.2%) 순으로 나타났다. 이와 같은 혈류 감염에 대한 전통적인 병원균의 동정은 혈액 배양 검사의 양성 검체를 배양하여 얻은 순수 분리 집락균을 얻은 후 이 집락균을 따서 희석한 균희석액에 미생물의 기질 분해능을 원리로 한 여러 생화학적 반응을 통해 이루어진다. 이때 혈액 배양 검사는 최소 1일에서 5일까지 긴 시간이 소요되므로 균혈증의 조기 예측을 어렵게 하는 단점이 존재한다[6]. 이러한 방법은 병원균 동정에서 항생제 감수성 검사까지 많은 시간이 소요된다. 혈액 배양 검사 없이 혈액 샘플에서 중합효소 사슬반응(polymerase chain reaction, PCR)에 의해 병원균 및 항생제 저항성 마커를 직접 검출하려는 시도가 있었지만 중간 정도의 민감도(sensitivity)와 특이도(specificity)로 인해 큰 성공을 거두지 못했다[20]. 그 이후 병원균의 직접 검출이 아닌 혈액 배양 양성 검체에서 multiplex PCR로 검사함으로 최적화된 항생제 요법까지의 시간을 줄이는 것에 초점을 맞추게 되었다[21,22]. 그렇지만 이러한 PCR 기반 검사는 식별 가능한 병원균과 항생제 내성 유전자의 수가 적다. 무엇보다 혈액 배양 양성 검체를 사용함으로 인해 긴 시간이 소요되고 균혈증의 조기 예측을 위해 사용하기에는 뚜렷한 한계가 존재한다. 질량 분광계(mass spectrometer, MS)도 세균을 신속하게 동정할 수 있으나 여러 미생물이 동시에 감염될 경우에 분석이 어렵고, 마찬가지로 혈액 배양 양성 검체를 사용하는 한계점을 갖고 있다[23]. 최근 혈액 배양 양성 검체를 사용하는 한계점을 벗어나 차세대 염기서열 분석(next-generation sequencing, NGS)은 직접 환자 혈액의 cfDNA (cell-free DNA)를 검사한다. NGS는 혈액 내 바이러스, 세균, 진균을 동시에 동정할 수 있는 장점이 있다. 특히 cfDNA의 염기서열 분석은 혈액 배양 검사에서 자라지 않는 많은 미생물를 식별하는 장점이 있지만 균혈증이나 패혈증을 진단하는데 낮은 특이도를 보여 왔다[24]. 이런 이유는 우리 몸 안에 많은 공생 미생물에서 유래됐을 가능성이 높다.
혈액 배양 검사 프로세서의 단점을 극복하기 위해 다양한 임상적 데이터를 통해 균혈증의 조기 예측력을 높이기 위한 연구가 활발히 진행되고 있다[7-9]. 많은 논문들에서 균혈증과 procalcitonin의 유의한 연관성이 보고되었다[25]. 혈중 procalcitonin 양은 세균의 그람 특성에 따라 달라지게 되는데 최근 연구 결과들을 살펴보면 그람 양성 균혈증에 비해 그람 음성 균혈증에서 procalcitonin이 유의하게 더 높다고 알려져 있다[26–28]. 그러므로 균혈증 환자의 procalcitonin 양을 측정하여 그람 양성균이나 진균으로부터 그람 음성균을 구별하는 것이 가능하다[29]. 최근에는 procalcitonin/ albumin ratio를 통해 패혈증의 예측력을 높이려는 시도가 있어왔다[30]. 세균 감염의 위험이 있는 노인 환자의 예후를 평가하기 위한 바이오 마커로서 procalcitonin/albumin ratio의 유용성에 관한 연구 결과 또한 제시되고 있다[31]. 또한 발열성 요로 패혈증의 예측인자로써 procalcitonin/albumin ratio이 높은 진단적 예측력을 갖고 있는 것으로 확인되었다[32]. 이와 같은 연구 결과는 본 연구 결과를 뒷받침해 준다. 본 연구는 그람 음성 균혈증에서 procalcitonin 보다 procalcitonin/albumin ratio가 더 높은 진단적 예측력을 보임을 확인하였다. 이와 같은 혈액 지표는 균혈증 외에도 다른 감염성 질환의 중증도나 사망률 예측에 procalcitonin/albumin ratio와 BUN/albumin ratio가 사용되고 있다. 최근 연구에 의하면 COVID-19의 중증도나 사망률 예측에 procalcitonin/albumin ratio와 BUN/albumin ratio가 중요하다고 알려져 있다[33,34]. 또한 BUN/albumin ratio는 폐렴 예후[35], 고령 응급실 환자의 병원 내 사망률 예측[36], 중환자실 폐암 환자의 병원 내 사망률을 예측하는데 유용한 예측인자로써 간주되고 있다[37]. 그러므로 BUN/albumin ratio는 중환자실이나 응급실에서 그람 양성 균혈증 외에도 관련 질환의 중증도나 사망률을 예측할 수 있는 다유용성 측면에서 고려될 수 있는 지표이다. 본 연구에서 그람 양성 균혈증에 대한 BUN/albumin ratio의 AUC는 그람 음성 균혈증에 대한 procalcitonin/albumin ratio보다 낮았다(0.709 vs. 0.846). 그람 양성 균혈증과 BUN, albumin의 연관성에 관한 선행 연구는 거의 없으므로 이들 사이의 연관성을 입증하기 위한 후속 연구가 필요하다. 이와 같이 낮은 AUC 때문에 BUN/albumin ratio (AUC 0.709)를 그람 양성 균혈증의 조기 예측을 위해 사용하기는 다소 어려울 것으로 보인다. 이러한 제한점에도 불구하고 혈액 검사는 쉽고 빠르게 진행할 수 있다는 장점이 있으므로 이 지표를 통해 그람 양성 균혈증에 대한 모니터닝과 함께 PCR 검사, MS 검사, NGS 검사를 병행함으로써 균혈증의 조기 예측이 가능할 것으로 기대한다. 또한 다양한 정보가 함께 고려된다면 AI 기반 임상의사결정 지원을 위한 모델에 보완 변수로 이용될 수 있으며 이를 통해 보다 정확히 균혈증을 예측할 수 있을 것으로 판단된다.
2016년 미국의 Society of Critical Care Medicine (SCCM)과 유럽의 European Society of Intensive Care Medicine (ESICM)에서 패혈증의 진단에 관한 3번째 개정인 SEPSIS-3을 제안하였다. SCCM/ ESICM에서는 패혈증을 감염에 대한 숙주 반응의 조절 장애로 인해 생명을 위협하는 장기부전으로 정의하고, 패혈증의 기준으로 quick Sequential Organ Failure Assessment (qSOFA) 점수의 2점 이상 증가를 권고하였다. 최근 정의된 SCCM/ESICM의 패혈증에 대한 기준에 따르면 감염증을 동반하지 않더라도 qSOFA 점수가 2점 이상인 경우가 존재할 수 있으므로 감염증이 패혈증의 진단을 위해 반드시 요구되는 조건이라고 할 수 없다[38]. 하지만 여전히 균혈증은 패혈증으로 진행할 수 있기 때문에 패혈증의 예방 및 신속한 치료를 위해 균혈증에 대한 조기 예측과 모니터닝은 중요하다. 본 연구에서 그람 음성 균혈증의 조기 예측을 위한 procalcitonin/albumin ratio와 그람 양성 균혈증의 조기 예측을 위한 BUN/albumin ratio의 임상적 유용성을 확인하였다. 이와 같은 혈액 지표는 패혈증 지표인 SEPSIS-3의 SOFA score와 함께 중환자실이나 응급실에서 사용될 수 있겠다. 그러므로 그람 특성에 따른 균혈증의 조기 예측과 모니터닝을 위해 중환자실 또는 응급실에서 procalcitonin, BUN, albumin, lactate와 같은 혈액 검사 종목들이 일상 검사(routine test)로 시행될 필요가 있다.
본 연구는 그람 음성 균혈증 또는 그람 양성 균혈증을 예측하기 위한 새로운 혈액 지표를 제안하였지만 몇 가지 제한점을 가진다. 첫째, 대학병원의 의무기록을 바탕으로 하는 단면 조사 연구로서 명확한 인과 관계를 설명하기 어렵다. 둘째, 검사 건수가 부족한 검사실 검사 데이터를 포함할 수 없었다. 셋째, 혈액 검사 데이터 외에 환자의 기저 질환과 임상 증상을 고려하지 못했다. 균혈증이 발생하는 환자군들은 기저질환이나 전신상태 저하 등이 있는 경우가 많기 때문에 이를 보완하기 위해 추후 연구에는 propensity score matching 등을 사용해 볼 수 있겠다. 넷째, 프레셉신(presepsin), IL-6와 같은 염증 표지자를 같이 고려하지 못하였다. 그러므로 추후 다기관 연구로 연구 대상의 수를 늘려 그람 음성 균혈증에서 procalcitonin/albumin ratio와 그람 양성 균혈증에서 BUN/albumin ratio의 진단적 유용성에 대한 분석이 필요하다.
배경: 적절한 시기에 균혈증을 치료하지 않으면 패혈증이 발생할 수 있으므로 균혈증의 조기 예측이 중요하다. 우리는 혈액 검사가 그람 음성 균혈증과 그람 양성 균혈증을 예측하는 데 임상적으로 유용한지 알아보고자 했다.
방법: 2018년 1월 1일부터 2018년 12월 31일까지 가톨릭대학교 의정부성모병원에 내원한 환자 중 혈액 배양 검사를 받은 환자 16,569명의 의무기록을 후향적으로 분석하였다. 분석에 필요한 데이터가 불충분한 15,580명의 환자를 제외한 후 총 연구 대상자는 989명이었다.
결과: 주요 변수들을 보정한 후 그람 음성 균혈증에 대해 분석한 다변수 로지스틱 회귀분석에서 procalcitonin (odds ratio [OR] 1.02, P < 0.001), high-sensitivity C-reactive protein (OR 1.03, P = 0.010), albumin (OR 0.55, P = 0.010)이 통계적으로 유의하였다. 같은 모델에서 lactic acid (OR 1.08, P = 0.010), blood urea nitrogen (BUN) (OR 1.02, P = 0.010), albumin (OR 0.50, P = 0.005)은 그람 양성 균혈증에 대해 통계적 유의하였다. 우리는 다변수 로지스틱 회귀분석에서 유의하였던 혈액 검사들을 조합하여 혈액 지표들을 만들었다. 수신기 작동 특성 곡선(receiver operating characteristic curve)의 곡선하면적(area under the curve, AUC)을 비교한 결과, 그람 음성 균혈증에서 procalcitonin/albumin ratio의 AUC는 procalcitonin의 AUC보다 유의하게 높았고(0.846 vs. 0.837, P = 0.005), 그람 양성 균혈증에서 BUN/albumin ratio의 AUC는 BUN의 AUC보다 유의하게 높았다(0.709 vs. 0.679, P = 0.007).
결론: 그람 음성 균혈증의 조기 예측에 procalcitonin/albumin ratio가, 그리고 그람 양성 균혈증의 조기 예측에 BUN/albumin ratio가 도움을 줄 것으로 생각된다.
This study was approved by the institutional review board of Uijeongbu St. Mary’s Hospital (IRB No. UC19RESI0110). The board exempted the obtainment of informed consent.
No potential conflicts of interest relevant to this article were reported.
None.
1. Smith DA and Nehring SM. Bacteremia. StatPearls. https://www.ncbi.nlm.nih.gov/books/ NBK441979/ [Online] (last visited on 6 November 2023).
2. Fernández-Sarmiento J, Schlapbach LJ, Acevedo L, Santana CR, Acosta Y, Diana A, et al. Endothelial damage in sepsis: the importance of systems biology. Front Pediatr 2022;10:828968. 


3. Dugar S, Choudhary C, Duggal A. Sepsis and septic shock: guideline-based management. Cleve Clin J Med 2020;87:53-64. 

4. Uslan DZ, Crane SJ, Steckelberg JM, Cockerill FR, III, St. Sauver JL, Wilson WR, et al. Age- and sex-associated trends in bloodstream infection: a population-based study in olmsted county, minnesota. Arch Intern Med 2007;167:834-9. 

5. Søgaard M, Nørgaard M, Dethlefsen C, Schønheyder HC. Temporal changes in the incidence and 30-day mortality associated with bacteremia in hospitalized patients from 1992 through 2006: a population-based cohort study. Clin Infect Dis 2011;52:61-9. 

6. Doern GV, Carroll KC, Diekema DJ, Garey KW, Rupp ME, Weinstein MP, et al. Practical guidance for clinical microbiology laboratories: a comprehensive update on the problem of blood culture contamination and a discussion of methods for addressing the problem. Clin Microbiol Rev 2019;33:e00009-19. 


7. Lien F, Lin HS, Wu YT, Chiueh TS. Bacteremia detection from complete blood count and differential leukocyte count with machine learning: complementary and competitive with c-reactive protein and procalcitonin tests. BMC Infect Dis 2022;22:287. 


8. Colak A, Aksit MZ, Toprak B, Yılmaz N. Diagnostic values of neutrophil/lymphocyte ratio, platelet/lymphocyte ratio and procalcitonin in early diagnosis of bacteremia. Turk J Biochem 2020;45:57-64. 
9. Ljungström L, Pernestig AK, Jacobsson G, Andersson R, Usener B, Tilevik D. Diagnostic accuracy of procalcitonin, neutrophil-lymphocyte count ratio, C-reactive protein, and lactate in patients with suspected bacterial sepsis. PLoS One 2017;12:e0181704. 


10. Hoeboer SH, van der Geest PJ, Nieboer D, Groeneveld ABJ. The diagnostic accuracy of procalcitonin for bacteraemia: a systematic review and meta-analysis. Clin Microbiol Infect 2015;21:474-81. 

11. Markanday A. Acute phase reactants in infections: evidence-based review and a guide for clinicians. Open Forum Infect Dis 2015;2:ofv098. 


12. Wang H, Ran J, et al. Urea. In: Yang B and Sands J, eds. Urea transporters. Subcellular biochemistry. Dordrecht; Springer, 2014:7-29. 

13. Washio Y, Ito A, Kumagai S, Ishida T, Yamazaki A. A model for predicting bacteremia in patients with community-acquired pneumococcal pneumonia: a retrospective observational study. BMC Pulm Med 2018;18:24. 


14. Wiedermann CJ. Hypoalbuminemia as surrogate and culprit of infections. Int J Mol Sci 2021;22:4496. 


15. Gatta A, Verardo A, Bolognesi M. Hypoalbuminemia. Intern Emerg Med 2012;7:S193-9. 

16. Zou XL, Feng DY, Wu WB, Yang HL, Zhang TT. Blood urea nitrogen to serum albumin ratio independently predicts 30-day mortality and severity in patients with escherichia coli bacteraemia. Med Clin 2021;157:219-25. 

17. Güneş H, Yurttutan S, Çobanuşağı M, Doğaner A. CRP/albumin ratio: a promising marker of gram-negative bacteremia in late-onset neonatal sepsis. Turk Arch Pediatr 2021;56:32-6.
18. DeLong ER, DeLong DM, Clarke-Pearson DL. Comparing the areas under two or more correlated receiver operating characteristic curves: a nonparametric approach. Biometrics 1988;44:837-45. 

19. Diekema DJ, Hsueh PR, Mendes RE, Pfaller MA, Rolston KV, Sader HS, et al. The microbiology of bloodstream infection: 20-year trends from the sentry antimicrobial surveillance program. Antimicrob Agents Chemother 2019;63:00355-19. 


20. Timsit JF, Ruppé E, Barbier F, Tabah A, Bassetti M. Bloodstream infections in critically ill patients: an expert statement. Intensive Care Med 2020;46:266-84. 


21. Huang TD, Melnik E, Bogaerts P, Evrard S, Glupczynski Y. Evaluation of the eplex blood culture identification panels for detection of pathogens in bloodstream infections. J Clin Microbiol 2019;57:01597-18. 


22. Berinson B, Both A, Berneking L, Christner M, Lütgehetmann M, Aepfelbacher M, et al. Usefulness of biofire filmarray bcid2 for blood culture processing in clinical practice. J Clin Microbiol 2021;59:e0054321. 


23. Scerbo MH, Kaplan HB, Dua A, Litwin DB, Ambrose CG, Moore LJ, et al. Beyond blood culture and gram stain analysis: a review of molecular techniques for the early detection of bacteremia in surgical patients. Surg Infect 2016;17:294-302. 


24. Blauwkamp TA, Thair S, Rosen MJ, Blair L, Lindner MS, Vilfan ID, et al. Analytical and clinical validation of a microbial cell-free DNA sequencing test for infectious disease. Nat Microbiol 2019;4:663-74. 

25. Jones AE, Fiechtl JF, Brown MD, Ballew JJ, Kline JA. Procalcitonin test in the diagnosis of bacteremia: a meta-analysis. Ann Emerg Med 2007;50:34-41. 

26. Li S, Rong H, Guo Q, Chen Y, Zhang G, Yang J. Serum procalcitonin levels distinguish gram-negative bacterial sepsis from gram-positive bacterial and fungal sepsis. J Res Med Sci 2016;21:39. 


27. Leli C, Ferranti M, Moretti A, Al Dhahab ZS, Cenci E, Mencacci A. Procalcitonin levels in gram-positive, gram-negative, and fungal bloodstream infections. Dis Markers 2015;2015:701480. 


28. Brodská H, Malíčková K, Adámková V, Benáková H, Šťastná MM, Zima T. Significantly higher procalcitonin levels could differentiate gram-negative sepsis from gram-positive and fungal sepsis. Clin Exp Med 2013;13:165-70. 

29. Wang D, Tao X, Guo W, Liu H, Cheng S, Wang J. The diagnostic ability of procalcitonin to differentiate gram-negative bacteria from gram-positive bacteria and fungal bloodstream infections in critically ill patients. Eur J Inflamm 2019;17:2058739219841469.J Inflamm 2019;17:2058739219841469.
30. Li T, Li X, Zhu Z, Liu X, Dong G, Xu Z, et al. Clinical value of procalcitonin-to-albumin ratio for identifying sepsis in neonates with pneumonia. Ann Med 2023;55:920-5. 


31. Higashikawa T, Okuro M, Ishigami K, Mae K, Sangen R, Mizuno T, et al. Procalcitonin and albumin as prognostic biomarkers in elderly patients with a risk of bacterial infection. J Int Med Res 2018;46:2606-14. 


32. Luo X, Yang X, Li J, Zou G, Lin Y, Qing G, et al. The procalcitonin/albumin ratio as an early diagnostic predictor in discriminating urosepsis from patients with febrile urinary tract infection. Medicine 2018;97:e11078. 


33. Çakırca TD, Çakırca G, Torun A, Bindal A, Üstünel M, Kaya A. Comparing the predictive values of procalcitonin/albumin ratio and other inflammatory markers in determining COVID-19 severity. Pak J Med Sci 2023;39:450-5. 


34. Küçükceran K, Ayrancı MK, Girişgin AS, Koçak S, Dündar ZD. The role of the bun/albumin ratio in predicting mortality in COVID-19 patients in the emergency department. Am J Emerg Med 2021;48:33-7. 


35. Milas GP, Issaris V, Papavasileiou V. Blood urea nitrogen to albumin ratio as a predictive factor for pneumonia: a meta-analysis. Respir Med Res 2022;81:100886. 

36. Dundar ZD, Kucukceran K, Ayranci MK. Blood urea nitrogen to albumin ratio is a predictor of in-hospital mortality in older emergency department patients. Am J Emerg Med 2021;46:34954. 

37. Peng X, Huang Y, Fu H, Zhang Z, He A, Luo R. Prognostic value of blood urea nitrogen to serum albumin ratio in intensive care unit patients with lung cancer. Int J Gen Med 2021;14:7349-59. 


38. Jeon JH and Park DW. Controversies regarding the new definition of sepsis. Korean J Med 2017;92:342-8. 
1. Smith DA and Nehring SM. Bacteremia. StatPearls. https://www.ncbi.nlm.nih.gov/books/ NBK441979/ [Online] (last visited on 6 November 2023).
2. Fernández-Sarmiento J, Schlapbach LJ, Acevedo L, Santana CR, Acosta Y, Diana A, et al. Endothelial damage in sepsis: the importance of systems biology. Front Pediatr 2022;10:828968.
3. Dugar S, Choudhary C, Duggal A. Sepsis and septic shock: guideline-based management. Cleve Clin J Med 2020;87:53-64.
4. Uslan DZ, Crane SJ, Steckelberg JM, Cockerill FR, III, St. Sauver JL, Wilson WR, et al. Age- and sex-associated trends in bloodstream infection: a population-based study in olmsted county, minnesota. Arch Intern Med 2007;167:834-9.
5. Søgaard M, Nørgaard M, Dethlefsen C, Schønheyder HC. Temporal changes in the incidence and 30-day mortality associated with bacteremia in hospitalized patients from 1992 through 2006: a population-based cohort study. Clin Infect Dis 2011;52:61-9.
6. Doern GV, Carroll KC, Diekema DJ, Garey KW, Rupp ME, Weinstein MP, et al. Practical guidance for clinical microbiology laboratories: a comprehensive update on the problem of blood culture contamination and a discussion of methods for addressing the problem. Clin Microbiol Rev 2019;33:e00009-19.
7. Lien F, Lin HS, Wu YT, Chiueh TS. Bacteremia detection from complete blood count and differential leukocyte count with machine learning: complementary and competitive with c-reactive protein and procalcitonin tests. BMC Infect Dis 2022;22:287.
8. Colak A, Aksit MZ, Toprak B, Yılmaz N. Diagnostic values of neutrophil/lymphocyte ratio, platelet/lymphocyte ratio and procalcitonin in early diagnosis of bacteremia. Turk J Biochem 2020;45:57-64.
9. Ljungström L, Pernestig AK, Jacobsson G, Andersson R, Usener B, Tilevik D. Diagnostic accuracy of procalcitonin, neutrophil-lymphocyte count ratio, C-reactive protein, and lactate in patients with suspected bacterial sepsis. PLoS One 2017;12:e0181704.
10. Hoeboer SH, van der Geest PJ, Nieboer D, Groeneveld ABJ. The diagnostic accuracy of procalcitonin for bacteraemia: a systematic review and meta-analysis. Clin Microbiol Infect 2015;21:474-81.
11. Markanday A. Acute phase reactants in infections: evidence-based review and a guide for clinicians. Open Forum Infect Dis 2015;2:ofv098.
12. Wang H, Ran J, et al. Urea. In: Yang B and Sands J, eds. Urea transporters. Subcellular biochemistry. Dordrecht; Springer, 2014:7-29.
13. Washio Y, Ito A, Kumagai S, Ishida T, Yamazaki A. A model for predicting bacteremia in patients with community-acquired pneumococcal pneumonia: a retrospective observational study. BMC Pulm Med 2018;18:24.
14. Wiedermann CJ. Hypoalbuminemia as surrogate and culprit of infections. Int J Mol Sci 2021;22:4496.
15. Gatta A, Verardo A, Bolognesi M. Hypoalbuminemia. Intern Emerg Med 2012;7:S193-9.
16. Zou XL, Feng DY, Wu WB, Yang HL, Zhang TT. Blood urea nitrogen to serum albumin ratio independently predicts 30-day mortality and severity in patients with escherichia coli bacteraemia. Med Clin 2021;157:219-25.
17. Güneş H, Yurttutan S, Çobanuşağı M, Doğaner A. CRP/albumin ratio: a promising marker of gram-negative bacteremia in late-onset neonatal sepsis. Turk Arch Pediatr 2021;56:32-6.
18. DeLong ER, DeLong DM, Clarke-Pearson DL. Comparing the areas under two or more correlated receiver operating characteristic curves: a nonparametric approach. Biometrics 1988;44:837-45.
19. Diekema DJ, Hsueh PR, Mendes RE, Pfaller MA, Rolston KV, Sader HS, et al. The microbiology of bloodstream infection: 20-year trends from the sentry antimicrobial surveillance program. Antimicrob Agents Chemother 2019;63:00355-19.
20. Timsit JF, Ruppé E, Barbier F, Tabah A, Bassetti M. Bloodstream infections in critically ill patients: an expert statement. Intensive Care Med 2020;46:266-84.
21. Huang TD, Melnik E, Bogaerts P, Evrard S, Glupczynski Y. Evaluation of the eplex blood culture identification panels for detection of pathogens in bloodstream infections. J Clin Microbiol 2019;57:01597-18.
22. Berinson B, Both A, Berneking L, Christner M, Lütgehetmann M, Aepfelbacher M, et al. Usefulness of biofire filmarray bcid2 for blood culture processing in clinical practice. J Clin Microbiol 2021;59:e0054321.
23. Scerbo MH, Kaplan HB, Dua A, Litwin DB, Ambrose CG, Moore LJ, et al. Beyond blood culture and gram stain analysis: a review of molecular techniques for the early detection of bacteremia in surgical patients. Surg Infect 2016;17:294-302.
24. Blauwkamp TA, Thair S, Rosen MJ, Blair L, Lindner MS, Vilfan ID, et al. Analytical and clinical validation of a microbial cell-free DNA sequencing test for infectious disease. Nat Microbiol 2019;4:663-74.
25. Jones AE, Fiechtl JF, Brown MD, Ballew JJ, Kline JA. Procalcitonin test in the diagnosis of bacteremia: a meta-analysis. Ann Emerg Med 2007;50:34-41.
26. Li S, Rong H, Guo Q, Chen Y, Zhang G, Yang J. Serum procalcitonin levels distinguish gram-negative bacterial sepsis from gram-positive bacterial and fungal sepsis. J Res Med Sci 2016;21:39.
27. Leli C, Ferranti M, Moretti A, Al Dhahab ZS, Cenci E, Mencacci A. Procalcitonin levels in gram-positive, gram-negative, and fungal bloodstream infections. Dis Markers 2015;2015:701480.
28. Brodská H, Malíčková K, Adámková V, Benáková H, Šťastná MM, Zima T. Significantly higher procalcitonin levels could differentiate gram-negative sepsis from gram-positive and fungal sepsis. Clin Exp Med 2013;13:165-70.
29. Wang D, Tao X, Guo W, Liu H, Cheng S, Wang J. The diagnostic ability of procalcitonin to differentiate gram-negative bacteria from gram-positive bacteria and fungal bloodstream infections in critically ill patients. Eur J Inflamm 2019;17:2058739219841469.
30. Li T, Li X, Zhu Z, Liu X, Dong G, Xu Z, et al. Clinical value of procalcitonin-to-albumin ratio for identifying sepsis in neonates with pneumonia. Ann Med 2023;55:920-5.
31. Higashikawa T, Okuro M, Ishigami K, Mae K, Sangen R, Mizuno T, et al. Procalcitonin and albumin as prognostic biomarkers in elderly patients with a risk of bacterial infection. J Int Med Res 2018;46:2606-14.
32. Luo X, Yang X, Li J, Zou G, Lin Y, Qing G, et al. The procalcitonin/albumin ratio as an early diagnostic predictor in discriminating urosepsis from patients with febrile urinary tract infection. Medicine 2018;97:e11078.
33. Çakırca TD, Çakırca G, Torun A, Bindal A, Üstünel M, Kaya A. Comparing the predictive values of procalcitonin/albumin ratio and other inflammatory markers in determining COVID-19 severity. Pak J Med Sci 2023;39:450-5.
34. Küçükceran K, Ayrancı MK, Girişgin AS, Koçak S, Dündar ZD. The role of the bun/albumin ratio in predicting mortality in COVID-19 patients in the emergency department. Am J Emerg Med 2021;48:33-7.
35. Milas GP, Issaris V, Papavasileiou V. Blood urea nitrogen to albumin ratio as a predictive factor for pneumonia: a meta-analysis. Respir Med Res 2022;81:100886.
36. Dundar ZD, Kucukceran K, Ayranci MK. Blood urea nitrogen to albumin ratio is a predictor of in-hospital mortality in older emergency department patients. Am J Emerg Med 2021;46:34954.
37. Peng X, Huang Y, Fu H, Zhang Z, He A, Luo R. Prognostic value of blood urea nitrogen to serum albumin ratio in intensive care unit patients with lung cancer. Int J Gen Med 2021;14:7349-59.
38. Jeon JH and Park DW. Controversies regarding the new definition of sepsis. Korean J Med 2017;92:342-8.